A tabela periódica atual
Em 1913 e 1914, o inglês Henry Moseley fez importantes descobertas trabalhando com uma técnica envolvendo raios X. Ele descobriu uma característica dos átomos que ficou conhecida como número atômico.
Nesse momento, basta dizer que cada elemento químico possui um número que lhe é característico, o número atômico. Quando os elementos químicos são organizados em ordem crescente de número atômico, ocorre uma periodicidade nas suas propriedades, ou seja, repetem-se regularmente elementos com propriedades semelhantes.
Essa regularidade da natureza é conhecida como lei periódica dos elementos.
Outros cientistas aprimoraram as descobertas de Mendeleev e de Moseley. Esses aprimoramentos conduziram à moderna tabela periódica dos elementos, que aparecem na tabela abaixo.
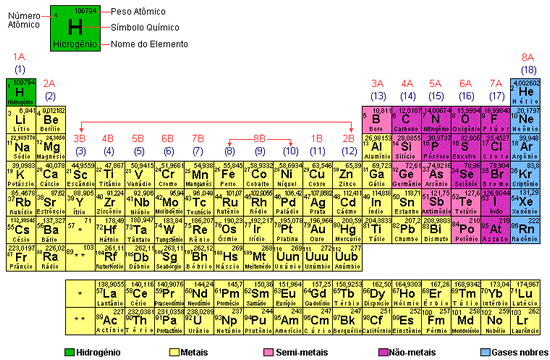
Nela, as linhas horizontais são chamadas de períodos e as colunas (verticais) são denominadas grupos, ou famílias.
A tabela é constituída de períodos e famílias
A simples localização de um elemento químico na tabela periódica já pode indicar diversas características específicas desse elemento.
Os períodos
Os elementos são distribuídos na tabela em ordem crescente da esquerda para a direita em linhas horizontais, de acordo com o número atômico (Z) de cada elemento, que fica acima de seu símbolo.
Observe a tabela acima. Na tabela há sete linhas horizontais, que são denominadas períodos.
Os períodos indicam o número de camadas ou níveis eletrônicos que o átomo possui. Por exemplo, o potássio (K) está localizado no quarto período, e o césio (Cs), no sexto. Isso significa que na distribuição eletrônica o potássio possui quatro camadas ou níveis eletrônicos e o césio possui seis.
O paládio (Pd) é uma exceção: apesar de estar na quinta linha horizontal, só possui quatro camadas ou níveis eletrônicos.
Os elementos de um mesmo período possuem o mesmo número de camadas eletrônicas, que por sua vez é coincidente com o número do período. Por exemplo:
| Período | Nº de camadas | Camadas | ||||||
|---|---|---|---|---|---|---|---|---|
1
|
1
|
K
| ||||||
2
|
2
|
K
|
L
| |||||
3
|
3
|
K
|
L
|
M
| ||||
4
|
4
|
K
|
L
|
M
|
N
| |||
5
|
5
|
K
|
L
|
M
|
N
|
O
| ||
6
|
6
|
K
|
L
|
M
|
N
|
O
|
P
| |
7
|
7
|
K
|
L
|
M
|
N
|
O
|
P
|
Q
|
As famílias
Observe que na tabela periódica existem 18 linhas verticais ou colunas. Elas representam as famílias ou os grupos de elementos químicos.
Acima das colunas existem números (1, 2, 3 etc.).
Cada coluna representa uma família; por exemplo:
- 1 é a família dos metais alcalinos;
- 2 é a família doa alcalinos terrosos;
- 18 é a família dos gases nobres.
Cada família química agrupa seus elementos de acordo com a semelhança nas propriedades. Por exemplo, a família 11 é composta pelos elementos químicos cobre (Cu), prata (Ag) e ouro (Au). Eles fazem parte do grupo dos metais e apresentam características comuns: brilho metálico, maleabilidade, ductibilidade, são bons condutores de calor e de eletricidade.
Assim com esses outros elementos, de uma mesma família possuem semelhanças em suas propriedades.
O número de algumas famílias indica quantos elétrons o elemento químico possui na última camada de sua elétrosfera. Acompanhe a seguir, alguns exemplos.
- O sódio (Na) está na família 1, isto é, possui um elétron na última camada de sua eletrosfera.
- O magnésio (MG) está na família 2, isto é, possui um elétron na última camada de sua elétrosfera.
- O alumínio (Al) encontra-se na família 3, pois esse elemento possui três elétrons na última camada de sua elétrosfera.
|
Os elementos químicos situados nas famílias 1 e 2 possuem o número de elétrons na última camada igual ao número da família a qual pertencem.
Para os das famílias 13 até 18, obtêm-se o número de elétrons na última camada, subtraindo-se 10 do número da família. Nas demais famílias essa regra não pode ser aplicada.
O hélio, apesar de estar na família 18, apresenta apenas dois elétrons na última camada, pois esse elemento possui apenas dois elétrons.
|
Metais, não-metais e semimetais
Na tabela periódica da pagina anterior, os elementos destacados em amarelo formam substâncias simples com algumas propriedades razoavelmente semelhantes. Essas substancias, de modo geral, conduzem bem a corrente elétrica e o calor, são facilmente transformadas em lâminas e em fios e são sólidas nas condições ambientes (isto é, 25ºC de temperatura e pressão equivalente ao valor médio da pressão atmosférica ao nível do mar), exceção feita àquela substância formada pelo mercúrio (Hg), que é líquida. Esses elementos são denominados metais.
Os elementos destacados em rosa e em azul formam substâncias simples que, ao contrário, não conduzem bem o calor nem a corrente elétrica (exceto o carbono na forma da substância simples o grafite), não são facilmente transformadas em lâminas ou em fios. Tais elementos são denominados não-metais (alguns os chamam de ametais). Dos não-metais, onze foram substâncias simples gasosas nas condições ambientes (hidrogênio, nitrogênio, oxigênio, flúor, cloro e gases nobres) uma forma substância líquida (bromo) e os demais formam substâncias simples sólidas.
Os elementos dos quadrinhos amarelos são os semimetais, assim denominados porque apresentam propriedades “intermediárias” entre a dos metais e a dos não-metais. Eles formam substâncias simples sólidas nas condições ambientes. Dois semimetais de muita importância prática são o silício e o germânio, empregados em componentes eletrônicos.
Gases nobres: modelo de estabilidade
Todas as substâncias químicas são formadas por átomos de elementos químicos. Os cientistas observaram que a imensa maioria das substâncias conhecidas é formada por átomos combinados, unidos. Ás vezes são átomos de um mesmo elemento, às vezes de elementos diferentes.
Dos milhões de substâncias conhecidas, sabe-se de apenas seis nas quais existem átomos não combinados. Essas substâncias são o hélio, o neônio, o xenônio, o argônio, o criptônio e o radônio, gases presentes em pequena quantidade na atmosfera terrestre. Esses gases são formados por átomos não combinados dos elementos do grupo 18 da tabela periódica (He, NE, Ar, Kr, Xe, RN), chamado grupo dos gases nobres.
Além disso, até hoje não foi descoberta sequer uma substância natural na qual átomos de gases nobres estejam combinados entre si ou com átomos de outros elementos.
Essas observações forneceram pistas aos cientistas, no final do século XIX e no início do século XX, para começarem a esclarecer como os átomos se combinam. Já que a eletrosfera é a parte mais externa dos átomos e o núcleo é muito pequeno, parece razoável ser a eletrosfera que atua na combinação dos átomos. E já que os gases nobres não tendem a se combinar, tudo indica que possuir uma eletrosfera semelhante à de gás nobre permite a um átomo estabilizar-se.
www.sobiologia.com.br
eu volter a estudar e muito bom.
ResponderExcluireu volter a estudar e muito bom.
ResponderExcluirGostei
ResponderExcluir