Professor de Matemática e Biologia Antônio Carlos Carneiro Barroso
Colégio Estadual Dinah Gonçalves
email accbarroso@hotmail.com
www.youtube.com/accbarroso1
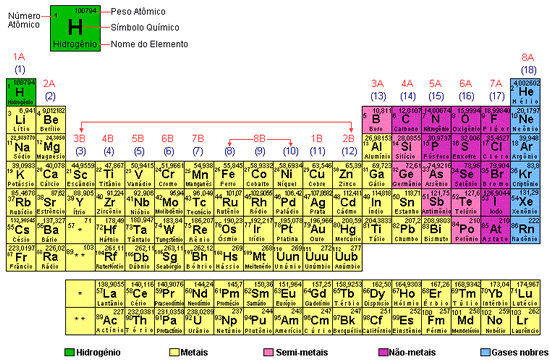
ÁCIDOS
Ácido de Arrhenius - Substância que, em solução aquosa, libera como cátions somente íons H+ (ou H3O+).
Nomenclatura
Ácido não-oxigenado (HxE):
ácido + [nome de E] + ídrico
Exemplo: HCl - ácido clorídrico
Ácidos HxEOy, nos quais varia o nox de E:
Grupo de E Nox de E Nome do ácido HxEOy Exemplo
7 7 ácido per + [nome de E] + ico HClO4 ácido perclórico
Nox do Cl = +7
a < 7 ácido [nome de E] + ico HClO3 ácido clórico
Nox do Cl = +5
b < a ácido [nome de E] + oso HClO2 ácido cloroso
Nox do Cl = +3
c < b ácido hipo + [nome de E] + oso HClO ácido hipocloroso
Nox do Cl = +1
G ¹ 7 G ácido [nome de E] + ico H3PO4 ácido fosfórico
Nox do P = +5
a < G ácido [nome de E] + oso H3PO3 ácido fosforoso
Nox do P = +3
b < a ácido hipo + [nome de E] + oso H3PO2 ácido hipofosforoso
Nox do P = +1
Ácidos orto, meta e piro. O elemento E tem o mesmo nox. Esses ácidos diferem no grau de hidratação:
1 ORTO - 1 H2O = 1 META
2 ORTO - 1 H2O = 1 PIRO
Nome dos ânions sem H ionizáveis - Substituem as terminações ídrico, oso e ico dos ácidos por eto, ito e ato, respectivamente.
Classificação
Quanto ao número de H ionizáveis:
* monoácidos ou ácidos monopróticos
* diácidos ou ácidos dipróticos
* triácidos ou ácidos tripróticos
* tetrácidos ou ácidos tetrapróticos
Quanto à força
* Ácidos fortes, quando a ionização ocorre em grande extensão.
Exemplos: HCl, HBr, HI . Ácidos HxEOy, nos quais (y - x) ³ 2, como HClO4, HNO3 e H2SO4.
* Ácidos fracos, quando a ionização ocorre em pequena extensão.
Exemplos: H2S e ácidos HxEOy, nos quais (y - x) = 0, como HClO, H3BO3.
* Ácidos semifortes, quando a ionização ocorre em extensão intermediária.
Exemplos: HF e ácidos HxEOy, nos quais (y - x) = 1, como H3PO4, HNO2, H2SO3.
Exceção: H2CO3 é fraco, embora (y - x) = 1.
Roteiro para escrever a fórmula estrutural de um ácido HxEOy
1. Ligue a E tantos -O-H quantos forem os H ionizáveis.
2. Ligue a E os H não-ionizáveis, se houver.
3. Ligue a E os O restantes, por ligação dupla (E = O) ou dativa (E ® O).
Ácidos mais comuns na química do cotidiano
* Ácido clorídrico (HCl)
o O ácido impuro (técnico) é vendido no comércio com o nome de ácido muriático.
o É encontrado no suco gástrico .
o É um reagente muito usado na indústria e no laboratório.
o É usado na limpeza de edifícios após a sua caiação, para remover os respingos de cal.
o É usado na limpeza de superfícies metálicas antes da soldagem dos respectivos metais.
* Ácido sulfúrico (H2SO4)
o É o ácido mais importante na indústria e no laboratório. O poder econômico de um país pode ser avaliado pela quantidade de ácido sulfúrico que ele fabrica e consome.
o O maior consumo de ácido sulfúrico é na fabricação de fertilizantes, como os superfosfatos e o sulfato de amônio.
o É o ácido dos acumuladores de chumbo (baterias) usados nos automóveis.
o É consumido em enormes quantidades em inúmeros processos industriais, como processos da indústria petroquímica, fabricação de papel, corantes, etc.
o O ácido sulfúrico concentrado é um dos desidratantes mais enérgicos. Assim, ele carboniza os hidratos de carbono como os açúcares, amido e celulose; a carbonização é devido à desidratação desses materiais.
o O ácido sulfúrico "destrói" o papel, o tecido de algodão, a madeira, o açúcar e outros materiais devido à sua enérgica ação desidratante.
o O ácido sulfúrico concentrado tem ação corrosiva sobre os tecidos dos organismos vivos também devido à sua ação desidratante. Produz sérias queimaduras na pele. Por isso, é necessário extremo cuidado ao manusear esse ácido.
o As chuvas ácidas em ambiente poluídos com dióxido de enxofre contêm H2SO4 e causam grande impacto ambiental.
* Ácido nítrico (HNO3)
o Depois do sulfúrico, é o ácido mais fabricado e mais consumido na indústria. Seu maior consumo é na fabricação de explosivos, como nitroglicerina (dinamite), trinitrotolueno (TNT), trinitrocelulose (algodão pólvora) e ácido pícrico e picrato de amônio.
o É usado na fabricação do salitre (NaNO3, KNO3) e da pólvora negra (salitre + carvão + enxofre).
o As chuvas ácidas em ambientes poluídos com óxidos do nitrogênio contém HNO3 e causam sério impacto ambiental. Em ambientes não poluídos, mas na presença de raios e relâmpagos, a chuva também contém HNO3, mas em proporção mínima.
o O ácido nítrico concentrado é um líquido muito volátil; seus vapores são muito tóxicos. É um ácido muito corrosivo e, assim como o ácido sulfúrico, é necessário muito cuidado para manuseá- lo.
* Ácido fosfórico (H3PO4)
o Os seus sais (fosfatos) têm grande aplicação como fertilizantes na agricultura.
o É usado como aditivo em alguns refrigerantes.
* Ácido acético (CH3 - COOH)
o É o ácido de vinagre, produto indispensável na cozinha (preparo de saladas e maioneses).
* Ácido fluorídrico (HF)
o Tem a particularidade de corroer o vidro, devendo ser guardado em frascos de polietileno. É usado para gravar sobre vidro.
* Ácido carbônico (H2CO3)
o É o ácido das águas minerais gaseificadas e dos refrigerantes. Forma-se na reação do gás carbônico com a água:
CO2 + H2O ® H2CO3
Ácidos
Segundo Arrhenius, ácidos são substâncias que, quando em solução aquosa, se dissociam, originando exclusivamente H+ como íons positivos. Na realidade, o H+ se associa a uma molécula de água, formando o H3O+.
HCl + H2O = Cl1- + H301+
H2SO4 + 2 H2O = SO42- + 2 H3O1+
Classificações dos ácidos
- presença ou não de oxigênio
Oxiácidos: presença de oxigênio na molécula.
Exemplos: H2SO4 , HNO3
Hidrácidos: oxigênio não presente na molécula.
Exemplos: HCl, HCN
- número de hidrogênios ionizáveis
Monoácidos: presença de 1 H ionizável.
HCl = H+ + Cl-
Diácidos: presença de 2 H ionizáveis.
H2SO4 = 2 H+ + SO42-
Triácidos: presença de 3 H ionizáveis.
H3PO4 = 3 H+ + PO43-
- volatilidade
Voláteis: são gasosos ou líquidos e com baixo ponto de ebulição: HNO3 , HCl e H2S
Fixos: muito pouco voláteis, somente H2SO4 e H3PO4
- grau de ionização
Representado pela letra grega alfa, o grau de ionização é a relação entre a quantidade de moléculas dissociadas e o total de moléculas dissolvidas. Quanto maior o valor de alfa, mais alta a tendência do ácido a se dissociar.
alfa (%) = (nº moléculas ionizadas / nº moléculas dissolvidas) x 100
ácidos fortes (alfa maior que 50%): HI, HBr, HCl, HNO3, H2SO4.
ácidos médios (alfa entre 5 e 50%): H2SO3, H3PO4, HF.
ácidos fracos (alfa menor que 5%): H2S, H3BO3, HCN. ácidos orgânicos.
Formulação dos ácidos
Juntam-se tantos H+ quantos forem necessários para neutralizar a carga do ânion. Para um ânion com carga x-, se utilizam x hidrogênios para formular o ácido.
Hx Ax-
Exemplos: NO31- HNO3
SO42- H2SO4
PO43- H3PO4
Nomenclatura dos ácidos
Hirácidos (H A): a nomenclatura se baseia no nome do elemento e na terminação ÍDRICO.
HCl ácido clorídrico HI ácido iodídrico H2S ácido sulfídrico
Oxiácidos (Hx A Oy): a nomenclatura se baseia no elemento central e no número de oxidação do mesmo na molécula ou no número de oxigênios do ácido. Deve-se memorizar os cinco ácidos de referência e os demais são obtidos, conforme o caso, adicionando-se ou retirando-se átomos de oxigênio da molécula do ácido.
Na tabela, o nox do elemento central e o número de oxigênios diminui da esquerda para a direita. As posições ocupadas por X indicam formulações não existentes.
máximo intermed. alto intermed. baixo mínimo
per+ico ico oso hipo+oso
HClO4 HClO3 HClO2 HClO
perclórico clórico cloroso hipocloroso
X H3PO4 H3PO3 H3PO2
fosfórico fosforoso hipofosforoso
X HNO3 HNO2 X
nítrico nitroso
X H2SO4 H2SO3 X
sulfúrico sulfuroso
X H2CO3 X X
carbônico
Os ácidos que servem de referência para a nomenclatura são os da coluna intermediário alto. A partir dele se classificam e nomeiam os demais ácido do elemento.
Quando se trata de ácidos que diferem entre si pelo número de hidratação, a nomenclatura pode se basear neste critério.
nível de hidrataçao do ácido prefixo
máximo ORTO
intermediário META
mínimo PIRO
O prefixo orto é dispensável e somente indica que tal ácido pode gerar outro por desidratação. O prefixo meta indica que tal ácido foi obtido pela retirada de uma molécula de água de uma molécula do orto. O prefixo piro indica que tal ácido foi obtido pela retirada de uma molécula de água de 2 moléculas do orto.
ácido (orto)fosfórico H3PO4
ácido metafosfórico HPO3 ( H3PO4 - 1 H2O )
ácido pirofosfórico H4P2O7 (2 H3PO4 ou H6P2O8 - 1 H2O)
A nomenclatura também pode se basear na tabela de ânions. Este tipode abordagem serve para hidrácidos e oxiácidos. Ao se dar nome a um ácido, deve-se levar em consideração a terminação do nome do ânion que origina o ácido.
terminação do ânion terminação do nome do ácido
ETO ÍDRICO
ATO ICO
ITO OSO
Cl1- cloreto HCl ácido clorídrico
SO42- sulfato H2SO4 ácido sulfúrico
Cl21- clorito HClO2 ácido cloroso
Um tipo de nomenclatura específica é a dos tioácidos. O prefixo tio é utilizado quando o ácido representa a molécula de um outro, com um átomo de enxofre (S) substituindo um de oxigênio na molécula original.
ácido ciânico HCNO ácido tiociânico HCNS
Função química é um conjunto de substâncias com propriedades químicas semelhantes. Dentre as principais funções estão os ácidos e bases.
Antes da formalização do conceito ácidos e bases
Ácidos eram caracterizados como:
Substâncias que tem sabor azedo
Conduzem corrente elétrica
Quando adicionados ao mármore e a outros carbonatos, produzir efervescência, com liberação de gás carbônico
e
Bases eram caracterizados como:
Possuir sabor adstringente, ou seja amarrar a boca
Tornar a pele lisa e escorregadia
Conduzir corrente elétrica
A formalização dos conceitos de ácido e base foi realizada por 3 teorias:
A primeira delas foi desenvolvida por Arrhenius em 1887 para explicar a condutividade elétrica de certas soluções, definiu ácidos e bases assim:
"Ácido é toda substância que em solução aquosa se dissocia fornecendo íons H+, como único tipo de cátion."
HCl
H+
+ Cl–
"Base é toda substância que , dissolvida em água, se dissocia, fornecendo íons hidróxido como único tipo de ânion."
NaOH
Na+
+OH –
Observações:
Os ácidos são compostos moleculares . Só conduzem a eletricidade em solução , pois há dissociação, formando íons. Quando puros não conduzem a eletricidade.
As bases são compostos iônicos, pois temos metal ligado ao oxigênio
Me+(OH) –
No estado sólido não conduzem a eletricidade, pois os íons estão presos. No estado fundido e em solução aquosa conduzem a corrente ,pois os íons estão libertos.
Entretanto , atualmente sabemos que um próton simples não existe em soluções aquosas. Um próton em solução aquosa se hidrata, forma cátion hidrônio: H3O+
A teoria de Bronsted – Lowry
Bronsted e Lowry em 1923, propuseram uma teoria mais ampla , válida para todos os meios ( meio alcóolico, meio aquoso, etc.)
Ácido= qualquer espécie química que doa prótons.
Base= qualquer espécie química que aceita prótons.
HBr
+
HOH
H3O+
+
Br –
Ácido
Base
Outro exemplo:
O que o íon amônio pode ser pela teoria de Bronsted – Lowry
NH4 +
NH3
+
H+
O íon amônio pode ceder prótons funcionando como ácido de Bronsted- Lowry e não pode ser base de Bronsted, pois não pode ganhar prótons.
A teoria de Lewis
Lewis em 1923, apresentou uma definição eletrônica de ácido e base, ele se baseou no conceito de base de Bronsted, que é a espécie que recebe próton, assim para receber próton, a base deve fornecer um par de elétrons para a ligação.
Ácido: toda espécie química que recebe par de elétrons.
Base: toda espécie química que doa par de elétrons.
Exemplo:
:NH3
+
HOH
[ H3N:H ] +
+
OH –
base
ácido NH 4+
O NH3 é uma base porque recebeu um próton H+ da água.
A água é um ácido porque cedeu um próton ao NH3.