Foi o cientista americano Linus C. Pauling quem apresentou a teoria até o momento mais aceita para a distribuição eletrônica.
Sobre Pauling, é sempre interessante citar que ele foi duas vezes laureado com o Prêmio Nobel. O de química em 1954, por suas descobertas sobre as ligações atômicas, e o da Paz em 1962, por sua militância contra as armas nucleares.
Para entender a proposta de Pauling, é preciso primeiro dar uma olhadinha no conceito de camadas eletrônicas, o princípio que rege a distribuição dos elétrons em torno do átomo em sete camadas, identificadas pelas letras K, L, M, N, O, P e Q.
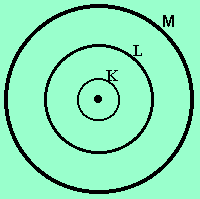
Uma característica destas camadas é que cada uma delas possui um número máximo de elétrons que podem comportar, conforme tabela que segue:
Camada
Número máximo de elétrons
K
2
L
8
M
18
N
32
O
32
P
18
Q
8
Pauling apresentou esta distribuição dividida em níveis e subníveis de energia, em que os níveis são as camadas e os subníveis divisões destes (representados pelas letras s, p, d, f), possuindo cada um destes subníveis também um número máximo de elétrons.
Subnível
Número máximo de elétrons
Nomenclatura
s
2
s2
p
6
p6
d
10
d10
f
14
f14
Quando combinados níveis e subníveis, a tabela de distribuição eletrônica assume a seguinte configuração:
Camada
Nível
Subnível
Total de elétrons
s2
p6
d10
f14
K
1
1s
2
L
2
2s
2p
8
M
3
3s
3p
3d
18
N
4
4s
4p
4d
4f
32
O
5
5s
5p
5d
5f
32
P
6
6s
6p
6d
18
Q
7
7s
7p
8
A distribuição eletrônica, conforme Pauling, não era apenas uma ocupação pelos elétrons dos espaços vazios nas camadas da eletrosfera.
Os elétrons se distribuem segundo o nível de energia de cada subnível, numa seqüência crescente em que ocupam primeiro os subníveis de menor energia e, por último, os de maior.
É esta a tradução do diagrama de energia de Pauling, que define esta ordem energética crescente que é também a seqüência de distribuição dos elétrons
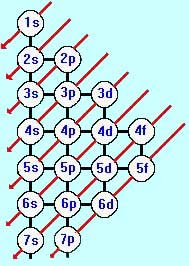
Diagrama de Linus Pauling
Na figura, as setas indicam a ordem crescente dos níveis de energia: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10
Note que como a energia de 4s2 é menor, esta posição vem antes de 3p6 e 3d10.
Assim, seguindo o diagrama de Pauling, podemos montar a distribuição eletrônica de qualquer elemento químico, como por exemplo:
Elemento químico Número atômico Distribuição eletrônica
He Hélio 2 1s2
K = 2
Cl Cloro 17 1s2 2s2 2p6 3s2 3p5
K = 2, L = 8, M = 7
Zr Zircônio 40 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2
K = 2, L = 8, M = 18, n = 10, O =2
Pt Platina 78 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 4f14 5d9
K = 2, L = 8, M = 18, N = 32, O = 16, P = 2
Lembre-se que a soma da distribuição dos elétrons, tanto nos subníveis quanto nas camadas deve bater com o número atômico, como no exemplo da Platina:
Camada
Nível
Distribuição eletrônica da platina
Total de elétrons
s2
p6
d10
f14
K
1
1s2
2
L
2
2s2
2p6
8
M
3
3s2
3p6
3d10
18
N
4
4s2
4p6
4d10
4f14
32
O
5
5s2
5p6
5d8
16
P
6
6s2
-
2
Q
7
-
-
Total
78
Algumas edições da Tabela Periódica informam também a distribuição eletrônica dos elementos químicos, o que facilita muito o trabalho de quem precisa operar estes dados.
Mas, independentemente disto, é muito importante conhecer os mecanismos que regem esta distribuição, e particularmente o conceito de níveis e subníveis de energia, ponto de partida para estudos mais avançados como os princípios da mecânica quântica.
*Carlos Roberto de Lana é engenheiro químico e professor.
Nenhum comentário:
Postar um comentário