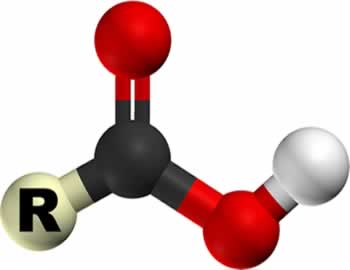
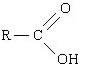
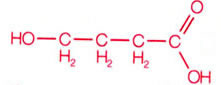
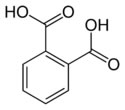
Ácido clorídrico (HCl)
O ácido impuro (técnico) é vendido no comércio com o nome de ácido muriático.
É encontrado no suco gástrico .
É um reagente muito usado na indústria e no laboratório.
É usado na limpeza de edifícios após a sua caiação, para remover os respingos de cal.
É usado na limpeza de superfícies metálicas antes da soldagem dos respectivos metais.
Ácido sulfúrico (H2SO4)
É o ácido mais importante na indústria e no laboratório. O poder econômico de um país pode ser avaliado pela quantidade de ácido sulfúrico que ele fabrica e consome.
O maior consumo de ácido sulfúrico é na fabricação de fertilizantes, como os superfosfatos e o sulfato de amônio.
É o ácido dos acumuladores de chumbo (baterias) usados nos automóveis.
É consumido em enormes quantidades em inúmeros processos industriais, como processos da indústria petroquímica, fabricação de papel, corantes, etc.
O ácido sulfúrico concentrado é um dos desidratantes mais enérgicos. Assim, ele carboniza os hidratos de carbono como os açúcares, amido e celulose; a carbonização é devido à desidratação desses materiais.
O ácido sulfúrico "destrói" o papel, o tecido de algodão, a madeira, o açúcar e outros materiais devido à sua enérgica ação desidratante.
O ácido sulfúrico concentrado tem ação corrosiva sobre os tecidos dos organismos vivos também devido à sua ação desidratante. Produz sérias queimaduras na pele. Por isso, é necessário extremo cuidado ao manusear esse ácido.
As chuvas ácidas em ambiente poluídos com dióxido de enxofre contêm H2SO4 e causam grande impacto ambiental.
Ácido nítrico (HNO3)
Depois do sulfúrico, é o ácido mais fabricado e mais consumido na indústria. Seu maior consumo é na fabricação de explosivos, como nitroglicerina (dinamite), trinitrotolueno (TNT), trinitrocelulose (algodão pólvora) e ácido pícrico e picrato de amônio.
É usado na fabricação do salitre (NaNO3, KNO3) e da pólvora negra (salitre + carvão + enxofre).
As chuvas ácidas em ambientes poluídos com óxidos do nitrogênio contém HNO3 e causam sério impacto ambiental. Em ambientes não poluídos, mas na presença de raios e relâmpagos, a chuva também contém HNO3, mas em proporção mínima.
O ácido nítrico concentrado é um líquido muito volátil; seus vapores são muito tóxicos. É um ácido muito corrosivo e, assim como o ácido sulfúrico, é necessário muito cuidado para manuseá- lo.
Ácido fosfórico (H3PO4)
Os seus sais (fosfatos) têm grande aplicação como fertilizantes na agricultura.
É usado como aditivo em alguns refrigerantes.
Ácido acético (CH3 - COOH)
É o ácido de vinagre, produto indispensável na cozinha (preparo de saladas e maioneses).
Ácido fluorídrico (HF)
Tem a particularidade de corroer o vidro, devendo ser guardado em frascos de polietileno. É usado para gravar sobre vidro.
Ácido carbônico (H2CO3)
É o ácido das águas minerais gaseificadas e dos refrigerantes. Forma-se na reação do gás carbônico com a água:
CO2 + H2O ® H2CO3
Os ácidos nucléicos são as substâncias responsáveis pela transmissão da herança biológica: as moléculas que regem a atividade da matéria viva, tanto no espaço (coordenando e dirigindo a química celular por meio da síntese de proteínas) como no tempo (transmitindo os caracteres biológicos de uma geração a outra, nos processos reprodutivos).
Composição e natureza química. Já no segundo quartel do século XIX o cientista suíço Friedrich Miescher isolou uma substância procedente dos núcleos celulares, à qual chamou nucleína, que passou a ser chamada mais tarde de ácido nucléico, por seu forte grau de acidez. Mas só quando já ia avançado o século XX demonstrou-se que essa substância era na realidade o suporte da herança dos caracteres nos seres vivos. Em 1944, as experiências de Oswald Theodore Avery, Colin M. MacLeod e Maclyn McCarty determinaram que um dos ácidos nucléicos, o ADN ou ácido desoxirribonucléico podia transferir uma característica biológica de uma bactéria (no caso, um pneumococo) para outra, característica ausente antes da transmissão.
Os ácidos nucléicos são moléculas longas e complexas, de elevados pesos moleculares, constituídos por cadeias de unidades denominadas mononucleotídeos. Estes se compõem de um carboidrato ou açúcar de cinco átomos de carbono (uma pentose), de estrutura cíclica pentagonal, ao qual se une por um de seus extremos uma molécula de ácido fosfórico e, por outro, uma base nitrogenada também de estrutura fechada, seja púrica (que tem dois anéis com vários átomos de nitrogênio unidos ao esqueleto carbonado), seja pirimidínica (que consta de um só anel hexagonal no qual se inserem átomos de nitrogênio, oxigênio e, em alguns casos, um radical metila, -CH3). Os componentes variáveis nos mononucleotídeos são as bases, das quais há cinco tipos possíveis -- duas púricas, a adenina e a guanina, e três pirimidínicas, a citosina, a uracila e a timina --, e nessa variabilidade reside o caráter "informativo" dos ácidos nucléicos e sua funcionalidade como moléculas codificadoras de informação biológica.
O açúcar ou pentose pode ser de duas classes: em forma de ribose desoxigenada ou desoxirribose, que é a que constitui o esqueleto do ADN, ou, em sua variedade normal, conhecida simplesmente como ribose, própria do ARN. No primeiro caso, originam-se desoxirribonucleotídeos; no segundo, ribonucleotídeos.
Os mononucleotídeos se unem entre si para compor, como já foi dito, longas cadeias de centenas ou milhares de unidades que se dispõem em forma de estruturas filamentosas helicoidais, de dupla hélice no caso de ADN e de hélice simples no ARN. A borda de cada hélice é integrada pelas pentoses, que se engancham umas nas outras através dos restos de ácido fosfórico, enquanto o contato entre uma hélice e outra se efetua pelo estabelecimento de enlaces por parte das bases nitrogenadas, obedecendo a determinadas leis bioquímicas. Cada enlace é, pois, o resultado da interação de um par de bases, cada uma das quais correspondente a uma das hélices. O acoplamento das bases não é arbitrário e atende a exigências espaciais, químicas e estruturais muito precisas. Sempre se emparelham uma base púrica e uma pirimidínica: a adenina sempre com a timina ou uracila, e a guanina com a citosina.
Ácido desoxirribonucléico. O ADN, ácido desoxirribonucléico, é formado pela pentose desoxirribose, o ácido fosfórico e as bases citosina, timina, adenina e guanina. É a substância responsável pela herança biológica de todos os seres vivos, à exceção de muitos vírus, nos quais esse papel é representado pelo ARN.
No período denominado interfase, imediatamente anterior à divisão celular, o ADN experimenta o processo de autoduplicação, ou seja: suas moléculas duplicam-se, de modo que mais tarde, ao formarem-se as duas hélices-filhas a partir de uma única célula-mãe, cada uma delas possa receber a totalidade do material genético. Na autoduplicação, a dupla hélice se abre e cada um dos dois filamentos que a compõem se separa e se sintetiza, graças à intervenção de diferentes enzimas, o filamento complementar.
Ácido ribonucléico. O ARN é o ácido ribonucléico, constituído pela pentose ribose, o ácido fosfórico e as bases citosina, uracila (esta ausente do ADN), adenina e guanina. Compõe-se de uma só cadeia helicoidal e apresenta três classes, cada uma das quais cumpre uma função específica na célula: o chamado ARN mensageiro (ARNm), sintetizado pela ação de diversas enzimas a partir de um filamento de ADN que lhe serve de guia, no processo conhecido como transcrição; o ARN ribossômico, componente essencial, junto com as proteínas, dos orgânulos celulares chamados ribossomas; e o ARN de transferência, que translada os diversos aminoácidos (unidades estruturais das proteínas) até onde se está sintetizando uma molécula protéica, sob a direção de um ARNm, e os insere no ponto exato para obter a seqüência exata, no processo denominado tradução.
Síntese de proteínas. A síntese de proteínas ou tradução é o processo em função do qual se formam as seqüências de aminoácidos que constituem as proteínas, a partir de uma seqüência correlativa expressa pelo ARN mensageiro, numa linguagem de bases nitrogenadas. Assim, de um fragmento de ADN dado, que contém a informação precisa para que se forme uma proteína concreta, obtém-se uma cópia, a qual é o ARNm que guiará diretamente o processo de tradução. Ao ARNm unem-se vários ribossomas que, ao se deslocarem, efetuarão um autêntico processo de "leitura química".
Cada grupo de três bases do ARNm -- por exemplo GCC -- corresponde na linguagem nucleotídica a um aminoácido dado, neste caso a alanina. O ribossoma reconhece por meios químicos o caráter desse trio (designado em genética como códon) e um ARN de transferência leva até ele o aminoácido alanina. Vai-se formando assim, pouco a pouco, a seqüência que dará lugar à proteína. Cada aminoácido tem sua codificação correspondente, em geral de vários códones, também há trios que indicam o sinal de terminação.
O código genético representa, pois, na escala molecular, uma autêntica linguagem, da qual a célula se serve para crescer e reproduzir-se, o que é possível graças aos ácidos nucléicos.
Quanto a presença de oxigênio:
1- Hidrácidos – não possuem oxigênio.
Ex: HI, HCN, H4 [Fe(CN)6]
2- Oxiácidos – possuem oxigênio
Ex: HNO2, H3PO4, H4P2O7
Quanto a volatidade:
• Voláteis – apresentam grande tendência a evaporação.
Ex: HNO2, HNO3 e Hidrácidos
• Fixos: Apresentam pequena tendência à evaporação.
Ex: Os Oxiácidos
Quanto ao número de hidrogênios ionizáveis:
• Monoácidos: possuem 1 "H" ionizável.
Ex: HCl, HNO3, HClO4
• Diácidos: possuem 2 "H" ionizáveis.
Ex: H2S, H2CrO4, H2CO3
• Triácidos: possuem 3 "H" ionizáveis.
Ex: H3AsO4, H3SbO4, H3[Fe(CN)]
• Tetrácidos: possuem 4 "H" ionizáveis.
Ex: H4SiO4, H4P2O7
Quanto a força ou grau de organização:
X = nº de moléculas ionizadas .100
nº de moléculas dissolvidas
x menor ou igual a 50% é Ácido forte
x maior ou igual a 5% e x menor ou igual a 50% é Ácido moderado
x menor que 5% é Ácido fraco
Força dos hidrácidos
Fortes: HCl, HBr, HI
Moderado: HF
Fraco: os demais.
Força dos oxiáxidos
Regra de Pauling:
(nº de oxigênio) –( nº de "H" ionizavel) = x
x = 3 e 2 = Fortes
x = 1 = Moderados
x = 0 = Fraco
Nomenclatura Dos Hidrácidos
Ácido+ [nome do elemento]+ ídrico
Nox Do Elemento Central
Para se calcular o nox do elemento central basta multiplicar o número de oxigênio por -2 e somar ao número de hidrogênio. Depois, ingnora-se o sinal de menos.
H3P+5 o4
• Ácidos fortes, quando a ionização ocorre em grande extensão.
Exemplos: HCl, HBr, HI . Ácidos HxEOy, nos quais (y - x) ³ 2, como HClO4, HNO3 e H2SO4.
• Ácidos fracos, quando a ionização ocorre em pequena extensão.
Exemplos: H2S e ácidos HxEOy, nos quais (y - x) = 0, como HClO, H3BO3.
• Ácidos semifortes, quando a ionização ocorre em extensão intermediária.
Exemplos: HF e ácidos HxEOy, nos quais (y - x) = 1, como H3PO4, HNO2, H2SO3.
Exceção: H2CO3 é fraco, embora (y - x) = 1.
Bases são substancias que em contato com água se dissociam e liberam um único tipo de ânion que é OH-
ex: Ca(OH)2 + H2O → CaOH+aq + OH-aq
CaOH+aq + H2O → Ca+2aq + OH-aq
Ca(OH)2 + H2O → Ca+2aq + OH-aq
Classificação
Quanto ao número de hidroxilas:
• Monobases: bases com apenas uma hidroxila
• Dibases: bases com duas hidroxilas
• Tribases: bases com três hidroxilas
• Tetrabases: bases com quatro hidroxilas
Quanto a força:
• Bases fortes: > ou = a 50% de ionização. São fortes as bases com elementos dos grupos 1A e 2A.
• Bases fracas: < ou = a 5% de ionização. Bases com elementos dos demais grupos.
Quanto a solubilidade:
Por serem compostos iônicos, não há bases completamente insolúveis.
• Bases solúveis: bases com elementos do grupo 1A e NH4OH.
• Bases pouco solúveis: bases com elementos do grupo 2A, exceto Mg(OH)2
• Bases praticamente insolúveis: bases com elementos dos demais grupos incluindo Mg(OH)2
Nomenclatura
Quando o elemento tem nox fixo:
Hidróxido de ___________(nome do elemento)
nome do elemento
Quando o elemento tem nox variável:
Hidróxido ___________ ico (maior nox)
nome do elemento oso (menor nox)
ou
Hidróxido de ___________ (__)
nome do elemento nox em algarismos romanos
Estudo dos Sais
Um sal é formado pelo cátion de uma base e o âniom de um sal. O cátion que tiver hidroxilas so se liga com ânions sem hidrogênio. Ânions que tiverem hidrogênio só se ligam com cátions sem hidroxila. Ânions e cátions sem partes ionizáveis ligam-se com qualquer outro cátion e âniom, respectivamente.
Ácido + Base → Sal + H2O
Neutralização
A neutralização é feita para se verificar o número de moléculas que reagem, o número de moléculas de sal e de água que se originam. Começa verificando-se primeiro os metais, depois os semi-metais e após os ametais; em seguida verifica-se os oxigênios e hidrgênios.
Classificação
Sal Neutro:
São aqueles que apresentam um cátion diferente de H+ e um âniom diferente de OH-.
A casos como NaH2PO2 que são sais neutros apesar de terem dois H+. Isso é devido a eles serem originados de ácidos com H+ não ionizáveis. Qualquer sal que apresente H2PO2 ou HPO3 e não tiver hidroxila (OH-) será um sal neutro.
Sal Ácido:
São aqueles que apresentam um cátion diferente de H+, pelo menos um H+ e um âniom diferente de OH-.
Sal Básico:
São aqueles que apresentam um cátion diferente de H+, pelo menos um OH- e um âniom diferente de OH-.
Sal Duplo:
São aqueles que apresentam 2 cátions diferentes de H+ e entre si mais um ânion diferente de OH-. Podem apresentar apenas um cátion diferente de H+ mais dois ânions diferentes de OH- e entre si.
Nomenclatura
Estabelecemos aqui a nomenclatura de cátions. Elementos com nox fixo limita-se apenas ao nome do elemento; e que as nomenclaturas para nox variável são as seguintes:
Sufixos ico para o maior nox do elemento e oso para o menor nox (considera-se apenas os dois menores nox do elemento).
Número do nox em algarismos romanos, dentro de um parêntesis após o nome do elemento. É necessário também estabelecer nomenclatura para os ânions, trocando o sufixo dos ácidos dos quais se originam pelos seguintes sufixos:
Idrico → eto
Ico → ato
Oso → ito
Reações de Síntese
As reações de síntese são aquelas em que duas ou mais substancias reagem formando uma única.
2Mg + O---2 → 2MgO2
Reações de decomposição
As reações de decomposição são aquelas em que um substancia origina duas.
Reações de dupla troca
Ao reagirem as substancias trocam de cátions e ânions.
1- ácido + base → sal + h2O
1- ácido1 + sal2 → ácido2 + sal2 só ocorre reação se o ácido produzido for fraco ou volátil ou o sal insolúvel.
2- base1 + sal1 → base2 + sal2 é necessario que ambos os reagentes sejam solúveis, sendo a base resultante ou insoluvel ou fraca ou volatil ou o sal resultante tem que ser insolúvel
Reações de simples troca
As reações de simples troca são aquelas em que ou um cátion ou um ânion trocam de par. O cátion ou o ânion ficará com o elemento de maior reatividade.
Ex: 2Na + 2HCl → 2NaCl + H2
Reações de Oxi-redução
São as reações em que ocorre pelo menos uma oxidação e uma redução. Oxidação é o processo pelo qual um elemento perde elétrons, portanto aumenta o nox. Redução é o processo em que um elemento ganha um elétrons, portanto diminui o nox.
Reações com Óxidos
Os óxidos são obtidos através de combustões espontâneas ou não.
Ex: 2Mg + O2 → 2MgO 2Fe + 3/2-- O2 → Fe2O3
C2H5OH + 3 O2 → 2CO2 + 3H2O 2FeO + ½ O2 → Fe2O3
Quando um elemento de nox variável reage com oxigênio em quantidade suficiente, forma-se o óxido onde o elemento tem maior nox. Quando um óxido inferior (com o menor nox do elemento) reage com oxigênio, forma-se um óxido superior (com o maior nox do elemento). O óxido superior já não reage mais com oxigênio.
Óxido básico + Ácido → Sal + H2O:
Pega-se o cátion do óxido mantendo seu nox , desconsiderando a quantidade, e junta-se com o ânion do ácido (parte do ácido que não o H). Faz-se a neutralização.
Óxido ácido + Base → sal + H2O:
Pega-se o cátion da base (parte que não a hidroxila) com seu nox, desconsiderando a quantidade, e junta-se com o ânion do ácido obtido do óxido ácido. Faz-se a neutralização.
Óxido básico + Óxido ácido → Sal:
Pega-se o cátion do óxido básico com seu nox, desconsiderando a quantidade, e junta-se com o ânion do ácido obtido do óxido ácido. Faz-se a neutralização.
extraido de www.colaweb.com.br