Líria Alves
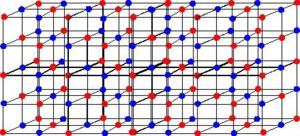
Estrutura cristalina do NaCl. Na+ em vermelho e Cl- em azul
Os íons ligam-se por causa das forças de atração eletrostática. No espaço onde cargas elétricas de sinais opostos se atraem acontece essa interação e como a atração entre os íons ocorre em todas as direções formam-se uma grade, denominada retículo cristalino.
Os retículos cristalinos são aglomerados com formas geométricas bem definidas, no retículo cristalino iônico, os cátions e os ânions são atraídos ao mesmo tempo.
Os íons que entram na composição de um composto iônico podem ser simples átomos, como ocorre no sal de cozinha ( Na+Cl- ) ou grupos mais complexos como ocorre no carbonato de cálcio ( Ca2+CO2-3 ).
Para que ocorra a atração eletrostática, numa ligação iônica deve haver, ao menos, uma carga positiva e outra negativa. Essa atração entre os íons é uma atração forte, o que determina as características físicas desses compostos. Estabelecida a ligação entre os íons, o composto resultante adquire a neutralidade. Algumas das propriedades dos compostos iônicos são:
1- As substâncias iônicas geralmente possuem maior ponto de fusão e ebulição que as substâncias moleculares;
2- São sólidos em ambientes com temperatura de 25 ºC e pressão de 1 atm.
3- São duros e quebradiços e logo que submetidos a impacto, quebram com facilidade, criando faces planas.
4- Quando dissolvidos em água, ou puros no estado líquido, transportam corrente elétrica devido à existência de íons que movimentam livremente e podem ser atraídos pelos eletrodos, fechando o circuito elétrico.
Nenhum comentário:
Postar um comentário