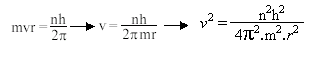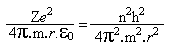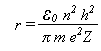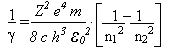O mosquito Aedes aegypti é muito parecido com um pernilongo comum. O Aedes é mais escuro e possue listras brancas pelo corpo e pelas patas. Tem o costume de atacar as pessoas durante o dia. Vive e se reproduz em ambientes com água limpa, próximos a habitação humana. Coloca seus ovos na parede de recepientes com água, como: vasos, tambores, pneus, etc.
Locais de incidência de criadouros, em porcentagem: vasos - 90%, os demais 10% em ordem decrescente são latinhas e copos descartáveis, caixa d'água, pneus, calhas.
Já foi detectado que os ovos sobrevivem até 2 anos sem contato com a água. E assim que tiver condições favoráveis eles eclodem e dão continuidade ao ciclo de vida.
CICLO DE VIDA
O culpado pela transmissão da doença é o mosquito africano Aedes aegypti, ou melhor, a fêmea do mosquito. As fêmeas da espécie depositam os ovos em um lugar próximo à superfície da água (mas fora dela, um pouco acima), que ficam aderidos à parede interna do recipiente.
O ciclo de vida do mosquito dura aproximadamente dez dias e machos e fêmeas alimentam-se de néctar e sucos vegetais. Mas, depois do acasalamento, a fêmea precisa de sangue para maturação dos ovos. E é dessa forma que ela é capaz de transmitir o vírus do dengue ao homem.
O dengue não é contagioso, ou seja, não é transmitido de pessoa para pessoa. Mas se o mosquito picar alguém doente e, após o vírus ter se multiplicado (no organismo do mosquito), picar uma pessoa sadia, ela vai desenvolver a doença.
DADOS SOBRE A DOENÇA
mosquito fêmea
Sintomas:
Os seguintes sintomas podem fazê-lo suspeitar de Dengue:
mosquitoDor de cabeça;
mosquitoDor nos olhos;
mosquitoFebre alta muitas vezes
(passando de 40 graus);
mosquitoDor nos músculos e nas
juntas;
mosquitoManchas avermelhadas por todo o corpo;
mosquitoFalta de apetite;
mosquitoFraqueza; e
mosquitoEm alguns casos, sangramento de gengiva e nariz.
TRATAMENTO DA DOENÇA
Infelizmente, não há tratamento específico para o dengue clássico, a versão menos grave da doença. O que os médicos fazem é combater os sintomas com antitérmicos e analgésicos. Casos mais graves de dengue hemorrágica exigem internação e reposição líquida, para repor a perda de sangue.
Mas a pessoa infectada deve beber muito líquido, descansar e evitar tomar antiinflamatórios e ácido acetilsalicílico (substância presente em remédios como Aspirina e AAS), porque eles favorecem as hemorragias. "O ácido acetilsalicílico altera o mecanismo de coagulação, por isso deve ser evitado. Isso não quer dizer que se a pessoa com dengue tomar esse medicamento vai morrer. A doença não é tão grave e menos de 1% dos pacientes que tem as manifestações mais sérias morrem", explica Luiz Jacintho da Silva, superintendente do Sucen (Superintendência de Controle de Endemias), órgão da Secretaria de Saúde do Estado de São Paulo.
Cuidado: não esqueça que se automedicar é uma atitude perigosa e totalmente desaconselhada pelos médicos. Mesmo assim, diante da epidemia de uma dengue, se você precisar de algum analgésico, prefira os à base de Paracetamol (como Acetofen, Parador, Trimedal, Tylenol) ou dipirona (como Anador, Analgex, Novalgina).
Aspectos Epidemiológicos:
Segundo o Guia de Doenças da Fundação Nacional de Saúde, o dengue é uma doença febril aguda, de etiologia viral e de evolução benígna na forma clássica, e grave quando se apresenta na forma hemorrágica.
O dengue é hoje a mais importante arbovirose que afeta o homem e constitui-se em sério problema de saúde pública no mundo, especialmente nos países tropicais, onde as condições do meio ambiente favorecem o desenvolvimento e a proliferação do Aedes aegypti, principal mosquito vetor.
Não existe vacina contra o dengue e por isso é difícil se prevenir contra ele - mas não é impossível e você é uma grande aliada nessa batalha. É que, para a contaminação ser evitada, é preciso combater a proliferação do mosquito. As secretarias de saúde tomam uma série de medidas nas áreas em que há focos de dengue, como visitas aos imóveis de determinada área para remover recipientes, destruir e fazer tratamento químicos nos criadouros. Quando não conseguem remover algum objeto, os técnicos aplicam larvicidas de baixa toxidade ou inseticidas especiais.
Infelizmente, os inseticidas comuns não resolvem o problema. Funcionam, no máximo, contra o inseto. Por isso, o jeito é não deixar acumular água limpa e parada dentro e fora de casa.
Agente Etiológico:
O vírus do Dengue é um arbovírus do gênero Flavivírus, pertencente à família Flaviviridae. São conhecidos quatro sorotipos: 1, 2, 3 e 4.
mosquito fêmea
Vetores Hospedeiros:
Os vetores são mosquitos do gênero Aedes. Nas Américas, o vírus do Dengue persiste na natureza mediante o ciclo de transmissão homem - Aedes aegypti - homem. O Aedes albopictus, já presente nas Américas e com ampla dispersão na Região Sudeste do Brasil, é o vetor de manutenção do Dengue na Ásia, mas até o momento não foi associado à transmissão do vírus do Dengue nas Américas. A fonte da infecção e hospedeiro vertebrado é o homem. Foi descrito na Ásia e na África um ciclo selvagem envolvendo o macaco.
Modo de Transmissão:
A transmissão se faz pela picada dos mosquitos Aedes aegypti, no ciclo homem - Aedes aegypti - homem. Após um repasto de sangue infectado, o mosquito está apto a transmitir o vírus, depois de 8 a 12 dias de incubação extrínseca. A transmissão mecânica também é possível, quando o repasto é interrompido e o mosquito, imediatamente, se alimenta num hospedeiro susceptível próximo. Não há transmissão por contato direto de um doente ou de suas secreções com uma pessoa sadia, nem de fontes de água ou alimento.
mosquiteiro
Período de Incubação:
Varia de 3 a 15 dias, sendo em média de 5 a 6 dias.
Período de Transmissibilidade:
A transmissão ocorre enquanto houver presença de vírus no sangue do homem (período de viremia). Este período começa um dia antes do aparecimento da febre e vai até o 6º dia da doença.
Suscetibilidade e Imunidade:
A suscetibilidade ao vírus do Dengue é universal.
A imunidade é permanente para um mesmo sorotipo (homóloga). Entretanto, a imunidade cruzada (heteróloga) existe temporariamente.
A fisiopatogenia da resposta imunológica à infecção aguda por Dengue pode ser: primária e secundária. A resposta primária se dá em pessoas não expostas anteriormente ao flavivírus e o título de anticorpos se eleva lentamente. A resposta secundária se dá em pessoas com infecção aguda por dengue, mas que tiverem infecção prévia por flavivírus e o título de anticorpos se eleva rapidamente em níveis bastante altos. A suscetibilidade em relação à FHD não está totalmente esclarecida.
dores
Características Clínicas e Diagnóstico diferencial:
1. A febre é a primeira manifestação e de início repentino.
2. A febre geralmente é alta, mais de 38oC (quando o paciente não faz uso de antitérmico).
3. A prostração é intensa nos adultos e pode-se arrastar mesmo após o término da febre.
4. Nas crianças pequenas o Dengue assemelha-se mais a uma infeção viral inespecífica, sendo os sintomas mais freqüentes a febre, o exantema (vermelhidão), o vômito e nas que já falam, a dor abdominal. Já a prostração é menos intensa.
5. O exantema nas pessoas de pele branca é máculo-papuloso, de cor avermelhada, com limites irregulares da mácula de base.
6. Em pessoas de pele negra ou morena, o exantema caracteriza-se mais pelas pequenas pápulas.
7. O exantema sempre aparece de uma vez, não apresentando seqüência ou uniformidade na distribuição.
8. O exantema pode aparecer em parte do corpo ou atingir o corpo todo. Pode ser tão intenso que chega a coalescer. Pode aparecer também nas palmas das mãos.
9. A maioria dos pacientes com exantema queixa-se de prurido e em alguns este sintoma é bastante intenso.
10. É raro o aparecimento de sintomas respiratórios (coriza, tosse, dor de garganta). Se estiverem presentes sem exantema, a suspeita é de gripe ou resfriado.
11. A febre com exantema, sintomas respiratórios e a presença de linfonodos palpáveis, principalmente os retro-cervicais faz pensar mais em Rubéola.
12. A febre com Koplik, conjuntivite, coriza intensa, tosse, exantema seqüencial (1o dia cabeça, 2o dia parte superior do tronco e membros superiores, 3o dia tronco inferior e membros inferiores) faz pensar mais em Sarampo.
13. Em caso de febre com exantema (pele em lixa), amigdalite purulenta, língua saburrosa, pode ser Escarlatina
14. No exantema máculo-papuloso com evolução para hemorrágico, pensar nas Ricketsioses (epidemiologia positiva para carrapatos na febre maculosa) e na meningococcemia..
15. Deve-se pesquisar os sinais clássicos da síndrome de irritação meníngea (rigidez de nuca, sinais de Kernig e Brudzinski) pois a febre alta, a cefaléia e vômitos são sintomas comuns aos dois quadros, Meningite e Dengue.
mosquito picando
Ações Clínicas:
* Realizar prova do laço (garrotear braço por um minuto e observar formação de mancha vermelha no mesmo) buscando identificar casos com tendências a alterações hemorrágicas.
* Encaminhamento imediato para realização de hematócrito (exame de sangue) e dosagem de plaquetas de todos os casos com prova do laço positiva e de todos os casos com alterações hemorrágicas, como: petéquias (bolinhas vermelhas no corpo), púrpuras (manchas avermelhadas no corpo), epistaxe (saliva com sangue), gengivorragias (sangramento nas gengivas), hemoptise (catarro com sangue), hematúria (urina com sangue), metrorragias (sangramento da pele), hematêmese (vômito com sangue), melena (sangue nas fezes), etc. Acompanhamento clínico-laboratorial desses casos até o 7o dia da doença.
* Encaminhamento para internação de todos os casos com sinais de alerta ou choque.
* Comunicação imediata por telefone com a Vigilância Epidemiológica dos Distritos de todos os casos com alterações hemorrágicas.
* Prescrição de antitérmico a base de Paracetamol (Tylenol).
* Orientação do paciente quanto: ao não uso de medicamentos que contenham Ácido Acetil Salicílico.
* Orientação do paciente para banhos frios ou banhos com amido de milho (Maizena - 1 colher de sopa para cada 10 litros de água) ou prescrição de pasta d'água para alívio do prurido.
* Orientação do paciente à ingestão freqüente de líquidos.
* Orientação do paciente à busca de atendimento imediato caso apareçam sinais ou sintomas de hemorragias, de hipotensão (pressão baixa) ou pré-choque (sinais de alerta).
* Fornecer atestado para afastamento do serviço.
Áreas de risco em destaque
Distribuição geográfica:
Nas Américas: o Dengue tem sido relatado nas Américas há mais de 200 anos. Na década de 50, a Febre Hemorrágica do Dengue - FHD foi descrita, pela primeira vez, nas Filipinas e Tailândia. Após a década de 60, a circulação do vírus do Dengue intensificou-se nas Américas. A partir de 1963, houve circulação comprovada dos sorotipos 2 e 3 em vários países. Em 1977, o sorotipo 1 foi introduzido nas Américas, inicialmente pela Jamaica. A partir de 1980, foram notificadas epidemias em vários países, aumentando consideravelmente a magnitude do problema. Cabe citar: Brasil (1982/1986-1996), Bolívia (1987), Paraguai (1988), Equador (1988), Peru (1990) e Cuba (1977/1981). A FHD afetou Cuba em 1981 e foi um evento de extrema importância na história do Dengue nas Américas. Essa epidemia foi causada pelo sorotipo 2, tendo sido o primeiro relato de Febre Hemorrágica do Dengue ocorrido fora do Sudoeste Asiático e Pacífico Ocidental. O segundo surto ocorreu na Venezuela, em 1989, e, em 1990/1991, alguns casos foram notificados no Brasil (Rio de Janeiro), bem como em 1994 (Fortaleza - Ceará).
No Brasil: há referências de epidemias em 1916, em São Paulo, e em 1923, em Niterói, sem diagnóstico laboratorial. A primeira epidemia documentada clínica e laboratorialmente ocorreu em 1981-1982, em Boa Vista - Roraima, causada pelos sorotipos 1 e 4. A partir de 1986, foram registradas epidemias em diversos estados. A mais importante ocorreu no Rio de Janeiro onde, pelo inquérito sorológico realizado, estima-se que pelo menos 1 milhão de pessoas foram afetadas pelo sorotipo Den 1, nos anos 1986/1987. Outros estados (Ceará, Alagoas, Pernambuco, Bahia, Minas Gerais, Tocantins, São Paulo, Mato Grosso e Mato Grosso do Sul) notificaram surtos no período de 1986/1993.
A introdução do sorotipo 2 foi detectada em 1990, no estado do Rio de Janeiro. Posteriormente, foi identificado também em Tocantins, Alagoas e Ceará. Atualmente existe transmissão de dengue em 20 Estados, com circulação simultânea dos sorotipos Den 1 e Den 2 em 14 deles.
Os casos de FHD registrados no estado do Rio de Janeiro após a introdução do sorotipo 2 (foram confirmados 462 casos e 8 óbitos em 1990/91), de uma forma geral, não apresentaram manifestações hemorrágicas graves, não necessitando portanto de internação hospitalar. O atendimento ambulatorial permitiu acompanhar os pacientes e orientá-los em relação à procura de assistência médica. A faixa etária mais atingida foi a de maiores de 14 anos.
mosquito
ALGUMAS DÚVIDAS SOBRE A DOENÇA
Seguem-se algumas dúvidas sobre a doença. As seis primeiras foram respondidas pelo infectologista Edimilson Migowski da UFRJ e as dez seguintes, publicadas no Jornal do Brasil de 24/02/02, p.24.
1. É possível distinguir a picada do Aedes aegypti da de um mosquito comum ?
Não. As sensações de incômodo ou dor são semelhantes às causadas pela de qualquer outro mosquito.
2. Como age o vírus da dengue no corpo humano, após a picada do Aedes?
O vírus invade alguma célula (pode ser do fígado ou um glóbulo branco, por exemplo) e dá início a um processo de multiplicação, até que esta se rompa. A partir daí, outras células são invadidas, até que o sistema imunológico identifique a ação e crie anticorpos. Esse processo se dá, geralmente, no quinto ou sexto dia de doença. A morte por dengue acontece quando a pessoa sofre uma lesão muito grave no fígado, desidrata ou tem grande queda de pressão arterial ou do número de plaquetas.
3. A pessoa pode estar com a doença e apresentar apenas alguns dos sintomas --- não ter enjôos e vômito, por exemplo ?
Sim. A intensidade dos sintomas varia muito de pessoa para pessoa. A febre e as dores no corpo, entretanto, são comuns a todos. Deve-se procurar um médico a partir da primeira desconfiança.
4. A pessoa pode confundir a dengue com uma virose ou gripe forte ? Como saber a diferença ?
Sim. Manchas avermelhadas pelo corpo podem ser um diferencial, mas elas não aparecem em todos os infectados. Para ter certeza, é preciso procurar atendimento médico e fazer exames.
5. Piscinas podem ser uma ameaça ?
Se estiverem recebendo tratamento adequado com aplicação correta de cloro, não. Caso contrário, serão grandes criadouros de mosquitos.
6. Quais os inimigos naturais do Aedes aegypti?
São os mesmos de qualquer mosquito: aranhas, pássaros, libélulas, lagartixas, morcegos, sapos e pererecas.
7. Os fumacês são indispensáveis nas ruas para eliminar os focos do Aedes aegypti?
Não. A ação é limitada, já que o inseticida só mata os mosquitos adultos. Além disso, como a maioria dos focos (cerca de 70%) está nas casas, nem sempre o veneno surte efeito.
8. Apenas quem tem dengue mais de uma vez desenvolve a forma hemorrágica?
Não. A maioria dos casos hemorrágicos ocorre na reincidência da doença. Isto não impede, embora seja mais raro, que alguns desenvolvam a forma mais grave no primeiro ataque do mosquito. A vítima pode, por exemplo, estar debilitada por outra infecção.
9. Quem tem dengue deve tomar Tylenol, para curar-se da doença ?
Sim, após consultado um médico. O medicamento atua sobre os sintomas, como febre e dores no corpo. A automedicação deve ser evitada, pois existe o perigo de intoxicação. Aos primeiros sintomas, deve-se procurar o médico.
10. O Aedes aegypti só ataca as pessoas de dia ?
Quase sempre, sim. O mosquito tem hábitos diurnos. Mas, se estiver faminto, pode, embora isto seja mais raro, picar também durante a noite.
11. Só a dengue hemorrágica é fatal ?
Não. A dengue clássica também pode matar, se a vítima já estiver debilitada. Pessoas com histórico de doenças cardíacas podem infartar.
12. Evita-se o mosquito, aplicando repelente no corpo três vezes ao dia ?
Sim. O odor do produto afasta mesmo o mosquito. Perfumes também têm esse efeito. O problema é que, com a transpiração, o repelente também é eliminado. Deve-se ter cuidado também com o uso indiscriminado em crianças, devido ao risco de terem reações alérgicas ao produto.
13. Velas à base de andiroba eliminam o risco de a pessoa pegar dengue em casa ?
Sim. O produto realmente inibe o mosquito. Mas seu raio de ação é limitado aos cômodos em que é usado.
14. Para evitar o mosquito, basta ingerir diariamente comprimidos de Complexo B?
Não. Os especialistas divergem sobre a eficácia do método. Até hoje não existe comprovação científica.
15. Em casa, os vasos de planta concentram os principais focos de larvas e ovos do Aedes aegypti?
Não. Fontes d´água potável, como poços e caixas d´água, oferecem mais condições que os vasos. Devem ser mantidos vedados.
16. Pingar algumas gotas de água sanitária nos vasos de planta evita que o mosquito deposite ovos no local ?
Sim. A fórmula caseira realmente faz efeito, já que as larvas se desenvolvem em água limpa. Mmas existem outras opções, como usar borra de café ou regar as plantas com um pouco de sal diluído.
COMO EVITAR A DOENÇA
combate ao mosquito
1. Evite deixar plantas em vasos com água, substituindo a água por terra.
2. Troque semanalmente a água dos vasos das plantas e lave com uma escova ou pano os pratinhos que acumulam água.
3. Lave as jarras de flores para eliminar os ovos dos mosquitos que ficam grudados nas suas paredes.
4. As latas vazias devem ser furadas antes de serem jogadas fora, para não acumular água.
5. As garrafas vazias devem ser guardadas de boca para baixo, pelo mesmo motivo anterior.
6. Lave os bebedouros dos animais com escova ou bucha e esvazie-os à noite, sempre que possível.
7. Pneus velhos devem ser mantidos em lugares cobertos, para não acumular água da chuva.
8. Os poços, tambores, caixas d´água, cisternas e outros depósitos de água devem estar sempre tampados.
9. O lixo caseiro deve estar ensacado e posto à disposição da limpeza urbana nos horários previstos.
10. Regue as plantas com solução de água sanitária (hipoclorito de sódio, na base de 40 gotas ou 1 colher de chá por litro de água), pelo menos 2 vezes por semana; principalmente as BROMÉLIAS.
11. Abrir as janelas de sua casa quando o fumacê passar.
12. Usar repelentes, velas de andiroba, mosquiteiros, telas nas portas e janelas e equipamentos elétricos de tomada.
Extraido do blog da Professora Eliete
.jpg)
.jpg)
.jpg)
.jpg)