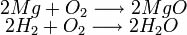BASES
1. Classificação
2. Ação de ácidos e bases sobre indicadores
3. Bases mais comuns na química do cotidiano
4. Teoria protônica de Brönsted-Lowry e teoria eletrônica de Lewis
Base de Arrhenius - Substância que, em solução aquosa, libera como ânions somente íons OH-.
Classificação
Solubilidade em água:
* São solúveis em água o hidróxido de amônio, hidróxidos de metais alcalinos e alcalino-terrosos (exceto Mg). Os hidróxidos de outros metais são insolúveis.
Quanto à força:
* São bases fortes os hidróxidos iônicos solúveis em água, como NaOH, KOH, Ca(OH)2 e Ba(OH)2.
* São bases fracas os hidróxidos insolúveis em água e o hidróxido de amônio.
O NH4OH é a única base solúvel e fraca.
Ação de ácidos e bases sobre indicadores
Indicador Ácido Base
tornassol róseo azul
fenolftaleína incolor avermelhado
alaranjado de metila avermelhado amarelo
Bases mais comuns na química do cotidiano
* Hidróxido de sódio ou soda cáustica (NaOH)
o É a base mais importante da indústria e do laboratório. É fabricado e consumido em grandes quantidades.
o É usado na fabricação do sabão e glicerina:
(óleos e gorduras) + NaOH ® glicerina + sabão
o É usado na fabricação de sais de sódio em geral. Exemplo: salitre.
HNO3 + NaOH ® NaNO3 + H2O
o É usado em inúmeros processos industriais na petroquímica e na fabricação de papel, celulose, corantes, etc.
o É usado na limpeza doméstica. É muito corrosivo e exige muito cuidado ao ser manuseado.
o É fabricado por eletrólise de solução aquosa de sal de cozinha. Na eletrólise, além do NaOH, obtêm-se o H2 e o Cl2, que têm grandes aplicações industriais.
* Hidróxido de cálcio (Ca(OH)2)
o É a cal hidratada ou cal extinta ou cal apagada.
o É obtida pela reação da cal viva ou cal virgem com a água. É o que fazem os pedreiros ao preparar a argamassa:
o É consumido em grandes quantidades nas pinturas a cal (caiação) e no preparo da argamassa usada na alvenaria.
* Amônia (NH3) e hidróxido de amônio (NH4OH)
o Hidróxido de amônio é a solução aquosa do gás amônia. Esta solução é também chamada de amoníaco.
o A amônia é um gás incolor de cheiro forte e muito irritante.
o A amônia é fabricada em enormes quantidades na indústria. Sua principal aplicação é a fabricação de ácido nítrico.
o É também usada na fabricação de sais de amônio, muito usados como fertilizantes na agricultura. Exemplos: NH4NO3, (NH4)2SO4, (NH4)3PO4
o A amônia é usada na fabricação de produtos de limpeza doméstica, como Ajax, Fúria, etc.
* Hidróxido de magnésio (Mg(OH)2)
o É pouco solúvel na água. A suspensão aquosa de Mg(OH)2 é o leite de magnésia, usado como antiácido estomacal. O Mg(OH)2 neutraliza o excesso de HCl no suco gástrico.
Mg(OH)2 + 2HCl ® MgCl2 + 2H2O
* Hidróxido de alumínio (Al(OH)3)
o É muito usado em medicamentos antiácidos estomacais, como Maalox, Pepsamar, etc.
Teoria protônica de Brönsted-Lowry e teoria eletrônica de Lewis
Teoria protônica de Brönsted-Lowry - Ácido é um doador de prótons (H+) e base é um receptor de prótons.
ácido(1) + base(2) Û ácido(2) + base(1)
Um ácido (1) doa um próton e se tranforma na sua base conjugada (1). Um ácido (2) doa um próton e se tranforma na sua base conjugada (2).
Quanto maior é a tendência a doar prótons, mais forte é o ácido.
Quanto maior a tendência a receber prótons, mais forte é a base, e vice-versa.
Teoria eletrônica de Lewis - Ácidos são receptores de pares de elétrons, numa reação química.
Bases têm sabor amargo e são semelhantes ao sabão quando as tocamos.
Se íons hidroxila são encontrados em uma solução, a solução é básica em natureza. Íons hidroxila são os únicos íons com carga negativa (ânions) formados quando uma base é dissolvida em água. Todas as propriedades de uma base se devem à presença destes íons. A fórmula química de um íon hidroxila é OH1-.
Bases são conhecidas como 'aceitadoras de prótons'.
Exemplos de Bases
Anti-Ácidos ajudam a neutralizar a acidez (do ácido clorídrico) no estômago. Eles geralmente contêm duas bases, chamadas hidróxido de magnésio e hidróxido de alumínio. A fórmula química do hidróxido de magnésio e hidróxido de alumínio é Mg(OH)2 e Al(OH)3 respectivamente.
Hidróxido de Sódio é também conhecido como 'Soda Cáustica'. Sua fórmula química é NaOH.
Hidróxido de Potássio é também conhecido como 'Potassa Cáustica'. É usado na manufatura de baterias alcalinas. Sua fórmula química é KOH.
Amônia é um gás básico o qual é usado na manufatura de fertilizantes como a Uréia, nitrato de amônio e sulfato de amônio. A amônia é produzida para fins comerciais através do processo de Haber. Quando dissolvida em água, a amônia forma uma base conhecida como hidróxido de amônio. A fórmula química da Amônia é NH3.
Base é toda substância que em solução aquosa, sofre dissociação iônica, liberando o ânion OH- (Hidróxido).
A dissociação iônica está relacionada ao comportamento das bases em presença de água. Exemplo: a soda cáustica (NaOH), é uma substância sólida que em contato com a água libera os íons Na+ e OH- que se dissolvem devido à atração pelos pólos negativos e positivos da molécula de H2O. Sendo assim, bases são substâncias compostas pela combinação de um cátion (geralmente de um metal) com o ânion OH-.
Uma das características das bases é seu sabor adstringente, que “amarra” a boca, ou seja, diminui a salivação.
Da mesma forma que os ácidos, as bases também conduzem corrente elétrica quando dissolvidas em água. Os indicadores fenolftaleína (solução) e papel de tornassol também mudam de cor em presença de hidróxidos. A fenolftaleína incolor torna-se vermelha; papel de tornassol vermelho fica azul: reações inversas às que verificamos no caso dos ácidos.
Vejamos as principais bases:
Hidróxido de Sódio (NaOH): Conhecida também como soda cáustica, essa substância é utilizada na fabricação do sabão, celofane, detergentes e raiom, produtos para desentupir pias e ralos, e também no processo de extração de celulose nas indústrias de papel, etc.
Hidróxido de Magnésio (Mg(OH)2): Está presente na solução que é comercializada com o nome de “leite de magnésia”, produto utilizado como laxante e antiácido estomacal.
Hidróxido de Cálcio (Ca (OH)2): Conhecida como cal hidratada ou cal extinta, essa substância é usada na construção civil: na preparação de argamassa (areia + cal) e na caiação (pintura a cal); as indústrias açucareiras utilizavam o hidróxido de cálcio na purificação do açúcar comum.
Hidróxido de Amônio (NH4OH): Essa substância é obtida em solução aquosa do gás de amônia e comercializada como amoníaco. É usado na fabricação de produtos de limpeza doméstica, na revelação de filmes fotográficos, em detergentes, na indústria têxtil, etc.
Hidróxido de Potássio (KOH): Conhecida como potassa cáustica, é usada para alvejamento, na fabricação de sabões moles e no processamento de certos alimentos.