Esse é o blog do Professor de Matemática Carlos Barroso. Trabalho no Colégio Estadual Dinah Gonçalves . Valéria-Salvador-Bahia .Inscreva-se Já no meu canal www.youtube.com/accbarroso1 e receba as videoaulas de Matemática.
segunda-feira, 29 de junho de 2020
Determinante
a) Menor complementar
O menor complementar de um elemento é o determinante da sua matriz quadrada. Para obtermos o menor complementar basta eliminar a linha e a coluna que o elemento pertence.
Obs.: todos elementos de uma matriz possui um menor complementar.
Exemplo:
Considere a matriz abaixo:



Qual a utilidade?
Através do Teorema de Laplace é possível obter o determinante de uma matriz de ordem n utilizando o determinante de matrizes de ordem n - 1. Portanto é possível abaixar a ordem.
e) Que fila escolhe?
Conforme o teorema, o determinante pode ser obtido por meio de qualquer fila. Para facilitar, devemos escolher a fila que tiver maior quantidade de zeros.
O menor complementar de um elemento é o determinante da sua matriz quadrada. Para obtermos o menor complementar basta eliminar a linha e a coluna que o elemento pertence.
Obs.: todos elementos de uma matriz possui um menor complementar.
Exemplo:
Considere a matriz abaixo:



Qual a utilidade?
Através do Teorema de Laplace é possível obter o determinante de uma matriz de ordem n utilizando o determinante de matrizes de ordem n - 1. Portanto é possível abaixar a ordem.
e) Que fila escolhe?
Conforme o teorema, o determinante pode ser obtido por meio de qualquer fila. Para facilitar, devemos escolher a fila que tiver maior quantidade de zeros.
Ionização e Volatilidade

Colégio Estadual Dinah Gonçalves
email accbarroso@hotmail.com
www.youtube.com/accbarroso1 Métodos de Ionização
A produção de íons nos espectrômetros de massas envolve vários fatores. Certos tipos de análises necessitam de íons em profusão e outros de seletividade. Há casos em que a energia com que se forma o íon é muito importante. Também, o estado da amostra pode determinar qual o método a ser usado.
Abaixo estão listados alguns métodos de ionização usados em espetrometria de massas:
* Ionização por elétrons
* Ionização por radiação Laser
* Ionização Química
* Ionização por Campo Elétrico
* Ionização de Superfície
* Ionização por Electrospray
Ionização por elétrons
Também conhecida por ionização por impacto eletrônico (IE), é a mais comum nos equipamentos de espectrometria de massas. A energia com que o elétron é acelerado pode, dependendo da amostra, provocar a formação de íons negativos, positivos ou a fragmentação com produção de espécies neutras e iônicas. Este método é largamente utilizado pois sua implementação básica é relativamente fácil, desde que a qualidade do feixe e a distribuição de energias dos elétrons não seja levada em consideração.
Ionização por Radiação Laser
Radiação laser é fornecida a átomos ou moléculas e dependendo do tipo de interação pode determinar a remoção de elétrons produzindo íons positivos.A absorção da energia proveniente do laser pelas ligações atômicas pode fragmentar a molécula produzindo espécies iônicas e moleculares.
Ionização Química
Um um modo alternativo de ionização é a ionização química (IQ). Alguns equipamentos, que contém um cromatógrafo acoplado, permitem através de um chaveamento automático a obtenção do espectro por impacto eletrônico (IE) e a ionização química (IQ). O método da IQ envolve a mistura da amostra ( em torno de 10-4Torr ) com um gás reagente em alta pressão ( 1 Torr) na fonte de formação dos íons. Os gases reagentes, comumente usados, são: metano, isobutano e amônia. A mistura resultante submetida ao bombardeio eletrônico ioniza, inicialmente, algumas moléculas do gás reagente. Deste modo, usando o gás metano as espécies esperadas são,CH4+. e CH3+. Em alta pressão, colisões destas espécies e reações íon-molécula com o próprio gás reagente são comuns, levando a formação de íons secundários, com um pequeno excesso de energia interna:
CH4+. + CH4 ==> CH5+ + CH3
CH3+ + CH4 ==> C2H5+ + H2
Estes íons secundários, eventualmente, colidem com moléculas da amostra, resultando na ionização química das últimas. A ionização química é, comumente, devido a protonação, especialmente para compostos básicos:
M + CH5+ ==> ( M + 1 )+ + CH4
Os íons, quase-moleculares, são espécies com elétrons pares que tendem a ser mais estáveis do que os íons moleculares produzidos por IE. A combinação da energia mais baixa no processo de ionização, com esta maior estabilidade, indica que os íons quase-moleculares são, geralmente, pouco abundantes no espectro de IQ.
A interpretação destes espectros é com freqüência mais direta do que para o espectro de IE, desde que existam poucos íons fragmentados, os quais tendem a ser de maior significância. A quantidade da fragmentação pode ser mudada pela natureza do gás reagente. Em geral, tanto as faixas dos compostos protonados e o grau de fragmentação observado decrescem quando o gás reagente é mudado na ordem: metano > isobutano > amônia. Por exemplo,a amônia protonará fracamente moléculas básicas tais como álcoois e aminas
IONIZAÇÃO POR CAMPO ELÉTRICO
Na ionização por campo elétrico, a amostra, termicamente volátil, é introduzida no equipamento por três maneiras: a) evaporada diretamente a partir de um dispositivo injetor de amostras (probe); b) por um cromatógrafo ou c) por uma entrada de gás. Portanto, as moléculas em fase gasosa que passarem próximo ao emissor são ionizadas por tunelamento de elétrons. Este método fornece espectros simples e apresenta ótima eficiência para moléculas orgânicas pequenas e alguns compostos de frações originárias de petróleo.
IONIZAÇÃO DE SUPERFÍCIE
É freqüente o uso do termo " ionização de superfície " para designar o processo no qual a ionização ocorre a uma distância crítica de uma superfície. Métodos dependentes de superfícies, como desorção por campo (field desorption, FD), bombardeamento rápido por átomo (fast atom bombardment, FAB) e desorção por laser (laser desorption, LD) são, geralmente, descritos como métodos de ionização de superfície. Outro uso, mais restrito, do termo, "ionização de superfície" , interpreta a equação de Saha-Langmuir para explicar este processo (relatado no trabalho de Toshihiro Fujii, Eur. Mass Spectrom. 2, 91-114 (1996)).
Experimentalmente, um fluxo de M moléculas, provenientes de um feixe molecular, sofrem um efeito em uma superfície aquecida espalhalhando partículas neutras, Mo, positivas, M+, e negativas, M-. Considerando um estado estacionário, o fluxo de partículas que desorvem da superfície, (Mo + M+ ou M-) é igual ao das partículas M adsorventes na superfície a partir da fase gasosa. É relevante em trabalhos onde compostos orgânicos entram em contato com superfícies metálicas aquecidas (filamento de tungstênio ou rênio).
IONIZAÇÃO POR ELECTROSPRAY
Um método de ionização para a análise de proteínas, de polímeros sintéticos, ou complexos metálicos é o da ionização por electrospray (ESI). As amostras devem ser solúveis em solventes de baixo ponto de ebulição, como água, metanol, acetonitrila, e estáveis a baixas concentrações, em torno de 0,02 mols/L. Consiste em um sistema com uma agulha extremamente fina e uma série de colimadores. A solução, a ser analisada, é borrifada em uma câmara formando gotas com cargas. A medida que o solvente evapora resultam muitas moléculas com cargas que podem ser analisadas. É interessante observar que moléculas com cargas múltiplas, [M+nH]n+, podem ser formadas por este método.
Como é um método em que os íons são ionizados a pressão atmosférica, apresenta, também, uma relação com o método de Ionização Química a Pressão Atmosférica (APCI). Neste caso, um plasma é criado por uma agulha com descarga por efeito corona no final do capilar metálico, onde reações de transferência de prótons e pequenas fragmentações podem ocorrer de acordo com o solvente usado ([M+H]+, [M+Na]+ e M+).
A constante de equilíbrio
Considere a seguinte reação genérica: aA + bB <==> cC + dD. Chamaremos as velocidades das reações direta e inversa de V1 e V2, respectivamente. As equações que representam essas velocidades são:
V1 = K1 [A]a [B]b
V2 = K2 [C]c [D]d
K1 e K2 são as constantes de velocidade, também chamadas constantes cinéticas, das reações direta e inversa, respectivamente. No equilíbrio dinâmico, temos que V1 = V2, ou seja: K1 [A]a [B]b = K2 [C]c [D]d. Desta relação, resulta que Ke
Ke é a constante de equilíbrio, e seu valor só é constante a uma temperatura determinada. Variando-se a temperatura, o valor da constante se altera. A partir do valor de Ke, pode-se ter uma idéia do rendimento de uma reação: um valor grande de Ke indica um alto rendimento, já que, pela definição, Ke é a relação entre as concentrações dos produtos e as concentrações dos reagentes; logo, quanto maior o valor de Ke maior deverá ser o valor do numerador (produtos) em relação ao denominador (reagentes). Isto significa que a quantidade dos produtos formada no final da reação (equilíbrio) é superior à de reagentes remanescentes.
Equilíbrios ácido-base
A dissociação de ácidos fracos:
Sabemos que os ácidos fortes são aqueles que, em solução aquosa, têm praticamente 100% de suas moléculas dissociadas em íons. A porcentagem de moléculas não dissociadas é desprezível. Já os ácidos fracos não se dissociam totalmente. Assim, para estes últimos é possível calcular uma constante que irá relacionar a quantidade de moléculas dissociadas e a quantidade de moléculas não-dissociadas, quando o sistema atinge o equilíbrio. Essa constante de equilíbrio é chamada de constante de dissociação (Kd), e, como estamos tratando de ácidos, a chamaremos de Ka. No caso de ácidos fortes, não faz sentido esse tipo de relação, já que praticamente 100% de suas moléculas estão dissociadas.
A equação proposta por Arrhenius para a dissociação de um ácido HA é:
HA(aq) <====> H+(aq) + A-(aq)
Já a equação proposta por Brönsted-Lowry enfatiza o fato do ácido transferir um próton para a água:
HA(aq) + H2O(l) <====> H3O+(aq) + A-(aq)
A condição desse equilíbrio é escrita como [H3O+][A-] / [HA][H2O]. No entanto, como a concentração de moléculas de água permanece constante, ou seja, não influi nos cálculos da equação HA <====> H+ + A-, o equilíbrio pode ser escrito como [H+][A-] / [HA]. Isto seria o mesmo que considerar o íon H3O+ apenas como H+ (que é a espécie que realmente importa), mas como não existe o próton na sua forma livre, devemos saber que H+ está sob a forma de H3O+. Portanto, a constante de dissociação (Ka) para um ácido fraco HA pode ser definida como:
Ka = [H+][A-] / [HA]
A força de um ácido, isto é, seu grau de ionização em solução, é indicada pela magnitude de sua constante de dissociação (Ka). Quanto mais fraco o ácido, menor será o valor de Ka. No caso de ácidos polipróticos, ou seja, ácidos que possuem mais de um hidrogênio ionizável, irão existir mais de uma constante de dissociação. Isto porque a ionização de um ácido poliprótico ocorre em etapas, e cada etapa terá um valor para Ka. Veja como exemplo o ácido sulfuroso:
H2SO3(aq) + H2O(l) <====> H3O+(aq) + HSO3-(aq) Ka1 = 1,3 x10-2
HSO3-(aq) + H2O(l) <====> H3O+(aq) + SO32-(aq) Ka2 = 6,3 x 10-8
Podemos generalizar que a saída de um próton de um ácido poliprótico torna-se cada vez mais difícil, ou seja, o primeiro próton é liberado com mais facilidade em relação ao segundo e assim, sucessivamente (perceba que o valor de Ka diminui). Isto ocorre porque, com a saída do primeiro próton, a base conjugada tende a recapturar o próton cedido, simultaneamente à saída do segundo.
A dissociação de bases fracas:
A dissociação de uma base fraca em solução aquosa é semelhante à de um ácido fraco, exceto pelo fato de que a atenção é focalizada para a produção de íons OH-. Se considerarmos uma base fraca BOH qualquer, pela definição de Arrhenius a sua dissociação será escrita como:
BOH(aq) <====> B+(aq) + OH-(aq)
Já a equação proposta por Brönsted-Lowry enfatiza o fato da base agir como receptora de um próton da água:
BOH(aq) + H2O(l) <===> BH+(aq) + OH-(aq)
A condição do equilíbrio é escrita como BH+][OH-] / [BOH]. Portanto, a constante de dissociação para uma base fraca BOH (chamamos de Kb) pode ser definida como:
Kb = BH+][OH-] / [BOH]
Podemos abordar um caso interessante, envolvendo a substância amônia (NH3). À temperatura e pressão ambientes a amônia é um gás muito solúvel em água, com a qual forma uma solução básica. Acreditava-se, no passado, que a amônia reagia com a água formando uma base fraca de Arrhenius, de fórmula NH4OH (hidróxido de amônio). Apesar de hoje em dia ainda se considerar uma solução aquosa de amônia como hidróxido de amônio, sabe-se que moléculas NH4OH não existem, pois elas não só não podem ser isoladas como substância pura, como também pode ser demonstrado que estas moléculas não existem nem em solução. Por isso, a amônia é tratada como uma base de Brönsted-Lowry:
NH3(aq) + H2O(l) <==> NH4+(aq) + OH-(aq)
Para essa reação a condição do equilíbrio (Kb) é: [NH4+][OH-]] / [NH3]
Definição geral de equilíbrio químico
Uma das razões pelas quais as propriedades de um sistema em equilíbrio são muito importantes é que todas as reações tendem a alcançar um equilíbrio. De fato, se permitirmos, todas as reações químicas atingem um estado de equilíbrio, embora isso nem sempre seja evidente. Às vezes dizemos que uma reação química foi "completada", mas rigorosamente falando, não existem reações que consumam 100% dos reagentes. Todos os sistemas que reagem alcançam um estado de equilíbrio, no qual permanecem pequenas quantidades de reagentes que estão sendo consumidos, até que seja quase impossível de se medir.
Considere a seguinte reação: CO2 (g) + H2 (g) ====> CO(g) + H2O(g)
Suponha que certa quantidade de CO2 e H2 estão contidas em um recipiente hermeticamente fechado e que disponhamos de um instrumento que nos permita acompanhar o desenvolvimento da reação. Após o início da reação, percebemos que as concentrações dos reagentes (CO2 e H2) diminuem e que as dos produtos (CO e H2O) aumentam. (Todas essas concentrações aumentam e diminuem na mesma proporção, já que a relação estequiométrica de todas as substâncias envolvidas, em razão mol por mol, é de 1:1).
Considerando que a reação se inicia no instante t0, as concentrações dos reagentes diminuíram e as dos produtos aumentaram. Veja, pelo gráfico, que as variações de concentração vão se tornando menos acentuadas desde o início da reação até o instante t3, em que o equilíbrio foi atingido. Isso significa que as velocidades de troca se tornam menores com o passar do tempo. No tempo t0 somente pode ocorrer a reação no sentido da formação dos produtos: A + B ===> C + D (reação direta). Entretanto, após certo tempo, quando significativa quantidade de produto já foi formada, pode se iniciar a reação no sentido contrário, ou seja, de se regenerar os reagentes: C + D ===> A + B (reação inversa). A velocidade da reação direta diminui com o tempo, devido ao decréscimo de reagentes (menor número de choques efetivos). Ao mesmo tempo, a velocidade da reação inversa aumenta, por causa do aumento da concentração dos produtos.
Finalmente, em t3, a velocidade da reação direta diminui e a da reação inversa aumenta, a ponto de se igualarem. A partir daí não há mais variação das concentrações de reagentes e produtos, uma vez que estes são formados e consumidos em velocidades iguais:
CO2 (g) + H2 (g) <====> CO(g) + H2O(g)
Regra de três
Professor de Matemática Antonio Carlos Carneiro Barroso
Colégio Estadual Dinah Gonçalves
email accbarroso@hotmail.com
1) Uma pessoa recebe R$ 10.000 por 25 dias de trabalho. Quanto receberia se tivesse trabalhando 8 dias a mais?a) R$ 12.300,00
b) R$ 10.400,00
c) R$ 11.300,00
d) R$ 13.100,00
e) R$ 13.200,00
2) No mesmo instante em que um prédio de 4,5m de altura projeta uma sombra de 13,5 m, qual a sombra projetada por uma torre de 130 m de altura?
a) 290m
b) 390m
c) 490m
d) 590m
e) 690m
3) A razão das idades de duas pessoas é 2/3. Achar estas idades sabendo que sua soma é 35 anos.
a) 14 e 20 anos
b) 14 e 21 anos
c) 15 e 20 anos
d) 18 e 17 anos
e) 13 e 22 anos
4) (FGV) Em 1º . 03 . 95 , um artigo que custava R$ 250,00 teve seu preço diminuído em p% do seu valor . Em 1o . 04 . 95 , o novo preço foi novamente diminuído em p% do seu valor , passando a custar R$ 211,60 . O preço desse artigo em 31. 03 . 95 era :
a) R$ 225,80
b) R$ 228,00
c) R$ 228,60
d) R$ 230,00
e) R$ 230,80
5) A razão das áreas de duas figuras é 4/7. Achar essas áreas sabendo que a soma é 66 cm².
a) 22cm² e 44cm²
b) 20cm² 46cm²
c) 21cm² e 45cm²
d) 24cm² e 42 cm²
e) 23cm² e 43cm²
6) A diferença dos volumes de dois sólidos é 9cm³ e a sua razão é 2/3. Achar os volumes.
a) 17cm³ e 28cm³
b) 18cm³ e 27cm³
c) 19cm³ e 28cm³
d) 20cm³ e 27cm³
e) n.d.a
7) Uma pessoa emprega uma quantia a juros simples de 6% durante 5 anos e o montante a juros simples de 12% ao ano durante 2 anos e recebeu R$ 80.600,00 de montante . Qual o capital inicial ?
a) R$ 50.000
b) R$ 60.000
c) R$ 70.000
d) R$ 80.000
e) R$ 90.000
8) (PUC) Em uma corrida de cavalos , o cavalo vencedor pagou aos seus apostadores R$ 9 por cada R$ 1 apostado . O rendimento de alguém que apostou no cavalo vencedor foi de:
a) 800%
b) 90%
c) 80%
d) 900%
e) 9%
9) (FEI) O custo de produção de uma peça é composta por : 30% para mão de obra , 50% para matéria prima e 20% para energia elétrica . Admitindo que haja um reajuste de 20% no preço de mão de obra , 35% no preço de matéria prima e 5% no preço da energia elétrica, o custo de produção sofrerá um reajuste de:
a) 60%
b) 160%
c) 24,5%
d) 35%
e) 4,5%
10) (UNESP) Entre 10 de fevereiro e 10 de novembro de 1990 o preço do quilograma de mercadorias num determinado "sacolão" sofreu um aumento de 275% . Se o preço do quilograma em 10de novembro era de Cr$ 67,50 , qual era o preço em 10 de fevereiro ?
a) Cr$ 19,00
b) Cr$ 18,00
c) Cr$ 18,50
d) Cr$ 19,50
e) Cr$ 17,00
11) (FUVEST) Suponha que a taxa de inflação seja 30% ao mês durante 12 meses ; daqui a um ano seja instituído o "cruzado novo ", valendo Cz$ 1000 ; e que sejam colocadas em circulação moedas de 10 centavos , 50 centavos e 1 cruzado novo . Qual será então o preço , em cruzados novos , de um cafezinho que custa hoje Cz$ 20,00 ?
a) NCZ$ 0,20
b) NCZ$ 0,30
c) NCZ$ 0,40
d) NCZ$ 0,50
e) NCZ$ 0,60
12) (FUVEST) O salário de Antônio é 90% do de Pedro . A diferença entre os salários é de R$ 500,00 . O salário de Antônio é:
a) R$ 5500,00
b) R$ 4500,00
c) R$ 4000,00
d) R$ 5000,00
e) R$ 3500,00
13) (FUVEST) Numa certa população 18% das pessoas são gordas , 30% dos homens são gordos e 10% das mulheres são gordas . Qual a porcentagem de homens na população ?
a) 30%
b) 35%
c) 40%
d) 45%
e) 50%
14) (FAAP) Numa cidade , 12% da população são estrangeiros . Sabendo-se que 11.968.000 são brasileiros , qual é a população total ?
a) 1.360.000
b) 13.600.000
c) 136.000.000
d) 10.531.840
e) 105.318.400
15) (FUVEST) O preço de uma certa mercadoria sofre anualmente um acréscimo de 100% . Supondo que o preço atual seja R$ 100,00 , daqui a 3 anos o preço será.
a) R$ 300,00
b) R$ 400,00
c) R$ 600,00
d) R$ 800,00
e) R$ 1000,00
16) (FGV) Se uma mercadoria sofre dois descontos sucessivos de 15% e depois um acréscimo de 8% , seu preço final , em relação ao preço inicial:
a) aumentou de 22%
b) decresceu de 21,97%
c) aumentou de 21,97%
d) decresceu de 23%
e) decresceu de 24%
17) (FGV) Uma fábrica de sapatos produz certo tipo de sapatos por R$ 18,00 o par , vendendo por R$ 25,00 o par . Com este preço , tem havido uma demanda de 2000 pares mensais . O fabricante pensa em elevar o preço em R$ 2,10. Com isto as vendas sofrerão uma queda de 200 pares . Com esse aumento no preço de venda seu lucro mensal:
a) cairá em 10%
b) aumentará em 20%
c) aumentará em 17%
d) cairá em 20%
e) cairá em 17%
18) (FGV) Se João emagrecesse 10 kg , ele passaria a ter 75% do seu peso atual . Então , seu peso atual é:
a) inferior a 30 kg
b) 75 kg
c) 50 kg
d) superior a 75 kg
e) 40 kg
19) (FGV) Um indivíduo ao engordar passou a ter 38% a mais em seu peso . Se tivesse engordado de tal maneira a aumentar seu peso em apenas 15%, estaria pesando 18,4 kg a menos . Qual era seu peso original ?
a) 50 kg
b) 60 kg
c) 70 kg
d) 80 kg
e) 40 kg
20) (FGV) Num colégio com 1000 alunos , 65% dos quais são do sexo masculino , todos os estudantes foram convidados a opinar sobre o novo plano econômico do governo . Apurados os resultados , verificou-se que 40% dos homens e 50% das mulheres manifestaram-se favoravelmente ao plano . A porcentagem de estudantes favoráveis ao plano vale:
a) 43,5%
b) 45%
c) 90%
d) 17,5%
e) 26%
21) (PUC) Em uma certa comunidade existem 200.000 professores de 1º e 2º graus que trabalham na rede oficial do Estado, 25.000 professores de 1º e 2º graus que trabalham na rede particular de ensino e 12.000 professores de 3º grau . Se 2,5% dos professores da rede oficial trabalham na rede particular , se 0,25% dos professores da rede oficial trabalham no 3º grau , e se 2% dos professores da rede particular trabalham no 3º grau , quantos professores possui essa comunidade , se apenas 200 professores trabalham , simultaneamente , na rede pública , particular , e no 3º grau ?
a) 213200
b) 231200
c) 212300
d) 223100
e) 231000
22) (ESPM) O salário médio de uma indústria de 354 funcionários é de R$ 3.300,00 . Se a indústria der um aumento de 20% para cada funcionário que possui , qual será o novo salário médio ?
a) R$ 3.690,00
b) R$ 369,00
c) R$ 396,00
d) R$ 3.960,00
e) n.d.a
23) (OSEC) Em apenas 6 meses o preço de um litro de gasolina teve 320% de aumento. Como esse preço era inicialmente de R$ 0,25 , ele passou a ser:
a) R$ 0,80
b) R$ 1,05
c) R$ 1,50
d) R$ 2,80
e) R$ 2,85
24) (FUVEST) Um recipiente contém uma mistura de leite natural e de leite de soja num total de 200 litros , dos quais 25% são de leite natural . Qual é a quantidade de leite de soja que deve ser acrescentada à essa mistura para que ela venha a conter 20% de leite natural ?
a) 40
b) 43
c) 48
d) 50
e) 60
25) (FGV) Duas irmãs , Ana e Lúcia , têm uma conta de poupança conjunta . Do total do saldo , Ana tem 70% e Lúcia 30% . Tendo recebido um dinheiro extra , o pai das meninas resolveu fazer um depósito exatamente igual ao saldo na caderneta . Por uma questão de justiça , no entanto , ele disse às meninas que o depósito deveria ser dividido igualmente entre as duas . Nessas condições , a participação de Ana no novo saldo:
a) diminui para 60%
b) diminuiu para 65%
c) permaneceu em 70%
d) aumentou para 80%
e) é impossível de ser calculada se não conhecermos o valor
26) (ESPM) O preço do papel sulfite , em relação ao primeiro semestre de 1989 , teve um aumento de 40% em agosto e um outro de 32% em setembro . No mês de novembro , teve um desconto de 25% . Qual seria o aumento do papel se ele fosse único?
a) 37%
b) 38,6%
c) 36,8%
d) 35,4%
e) 34,5%
27) Um automóvel com velocidade de 80 km/h demora 3h para percorrer uma certa distância.Quanto o tempo demorará para percorrer a mesma distância um outro auto cuja velocidade é de 120 km/h?
a) 2 horas
b) 3 horas
c) 4 horas
d) 5 horas
e) 6 horas
28) Uma roda de 30 dentes engrena com outra de 25 dentes. Quantas voltas dará esta última quando a primeira der 175 voltas.
a) 10 voltas
b) 110 voltas
c) 210 voltas
d) 310 voltas
e) 410 voltas
29) Para forrar as paredes de uma sala são necessárias 20 peças de papel com 80 cm de largura cada. Quantas peças seriam necessárias se as peças tivessem 1m de largura?
a) 15 peças
b) 16 peças
c) 17 peças
d) 18 peças
e) 19 peças
Porcentagem, razão e proporção
Gabarito dos exercícios
Questão 1 E
Questão 2 B
Questão 3 B
Questão 4 D
Questão 5 D
Questão 6 B
Questão 7 A
Questão 8 A
Questão 9 C
Questão 10 B
Questão 11 D
Questão 12 B
Questão 13 C
Questão 14 B
Questão 15 D
Questão 16 B
Questão 17 C
Questão 18 E
Questão 19 D
Questão 20 A
Questão 21 B
Questão 22 D
Questão 23 B
Questão 24 D
Questão 25 A
Questão 26 B
Questão 27 A
Questão 28 C
Questão 29 B
Fitogeografia Brasileira
Colégio Estadual Dinah Gonçalves
Fitogeografia Brasileira
Por Keilla Costa
Cerrado
• Floresta Amazônica
A floresta amazônica é a maior do mundo e ainda atinge 40% do território brasileiro. A mata amazônica abrange nove estados do território brasileiro, que são eles: Acre, Amazonas, Rondônia, Roraima, Amapá, Pará, Mato Grosso, Tocantins e Maranhão.
Essa floresta apresenta uma grande diversidade biológica. Na sua vegetação, podemos citar o cupuaçu, a seringueira, o açaí, o angelim e muitos outros. Além de apresentar plantas medicinais.
Na mata Amazônica podemos encontrar três tipos de vegetação:
- Mata de igapó: é uma região que sempre fica alagada, isso porque ela se localiza próximo ao rio.
- Mata de Várzea: nessa região predomina vários tipos de espécies.
- Mata de Terra firme – é uma região onde não ocorrem alagamentos e também é a maior em relação às outras matas.
• Mata Atlântica
É uma mata tropical. Tem seu início no Rio Grande do Norte e abrange até o Sul. A sua biodiversidade é muito grande. Dentre as plantas podemos citar o pau-brasil, jambo, jatobá e etc.
• Cerrado
É uma vegetação que se localiza na região Centro-Oeste. As plantas são denominadas de tropófilas, pois elas sobrevivem durante seis meses em clima seco e seis meses em clima úmido.
A fauna é diversificada, os animais que se destacam são o lobo-guará, onça-pintada, anta, tamanduá, tatu e veado-campeiro, ema e muitos outros.
• Mata de araucária
Essa mata localiza-se na região Sul do Brasil e abrange até São Paulo e Rio Grande do Sul. Na vegetação o que mais predomina é o pinheiro – do - paraná e também o pinheiro do gênero. Atualmente o pinheiro-do-paraná é o mais explorado, pois tem grande importância econômica.
• Caatinga
A caatinga localiza-se no Nordeste. Na fauna destacam-se os animais como o corrupião, a cascavel, o gavião-carcará e a ararinha-azul, que é uma ave que está sendo ameaçada de extinção.
A floresta amazônica é a maior do mundo e ainda atinge 40% do território brasileiro. A mata amazônica abrange nove estados do território brasileiro, que são eles: Acre, Amazonas, Rondônia, Roraima, Amapá, Pará, Mato Grosso, Tocantins e Maranhão.
Essa floresta apresenta uma grande diversidade biológica. Na sua vegetação, podemos citar o cupuaçu, a seringueira, o açaí, o angelim e muitos outros. Além de apresentar plantas medicinais.
Na mata Amazônica podemos encontrar três tipos de vegetação:
- Mata de igapó: é uma região que sempre fica alagada, isso porque ela se localiza próximo ao rio.
- Mata de Várzea: nessa região predomina vários tipos de espécies.
- Mata de Terra firme – é uma região onde não ocorrem alagamentos e também é a maior em relação às outras matas.
• Mata Atlântica
É uma mata tropical. Tem seu início no Rio Grande do Norte e abrange até o Sul. A sua biodiversidade é muito grande. Dentre as plantas podemos citar o pau-brasil, jambo, jatobá e etc.
• Cerrado
É uma vegetação que se localiza na região Centro-Oeste. As plantas são denominadas de tropófilas, pois elas sobrevivem durante seis meses em clima seco e seis meses em clima úmido.
A fauna é diversificada, os animais que se destacam são o lobo-guará, onça-pintada, anta, tamanduá, tatu e veado-campeiro, ema e muitos outros.
• Mata de araucária
Essa mata localiza-se na região Sul do Brasil e abrange até São Paulo e Rio Grande do Sul. Na vegetação o que mais predomina é o pinheiro – do - paraná e também o pinheiro do gênero. Atualmente o pinheiro-do-paraná é o mais explorado, pois tem grande importância econômica.
• Caatinga
A caatinga localiza-se no Nordeste. Na fauna destacam-se os animais como o corrupião, a cascavel, o gavião-carcará e a ararinha-azul, que é uma ave que está sendo ameaçada de extinção.
sexta-feira, 12 de junho de 2020
Volume do tronco de pirâmide
Colégio Estadual Dinah Gonçalves
email accbarroso@hotmail.com
Marcelo Rigonatto

Pirâmide
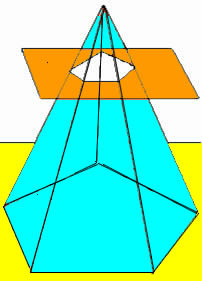
O volume do tronco de pirâmide é obtido fazendo a diferença entre o volume da pirâmide original e o volume da pequena pirâmide formada após a intersecção do plano. Dessa maneira, obtemos a fórmula que determina o volume do tronco de qualquer pirâmide.
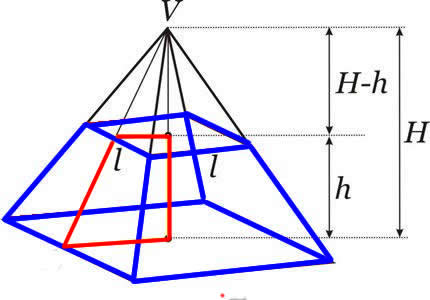
Fórmula do volume do tronco de pirâmide:
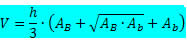
Onde
h → é a altura do tronco de pirâmide.
AB → é a área da base maior.
Ab → é a área da base menor.
Observe os seguintes exemplos para compreender como utilizar a fórmula.
Exemplo 1. Calcule o volume do tronco de pirâmide abaixo.
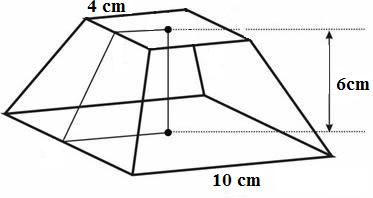
Solução: Observe que as bases desse tronco de pirâmide são quadrados e sua altura é de 6 cm. Para calcular o volume de um tronco de pirâmide qualquer, precisamos da área das duas bases e da medida da altura. Assim, teremos:
AB = 102 = 100 cm2
Ab = 42 = 16 cm2
h=6cm
Substituindo esses valores na fórmula do volume, obtemos:
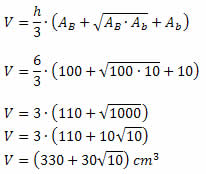
Exemplo 2. A base maior de um tronco de pirâmide é uma das faces de um cubo de 125 cm3 de volume. Sabendo que a base menor desse tronco é um quadrado de 2 cm de lado e sua altura é de 9 cm, calcule seu volume.
Solução: Como a base maior do tronco é uma das faces de um cubo, sabemos que sua base é um quadrado. Foi dado que o volume desse cubo é de 125 cm3, assim, cada aresta do cubo mede 5 cm. Dessa forma, a base maior do tronco é um quadrado de 5 cm de lado. Logo, teremos:
AB = 52 = 25 cm2
Ab = 22 = 4 cm2
h = 9 cm
Substituindo na fórmula do volume, teremos:
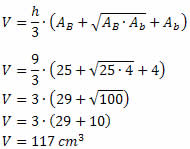
Dente
► Dentes
Características dos dentes
Os dentes são estruturas duras, calcificadas, presas aos maxilares superior e inferior, cuja atividade principal é a mastigação. Estão implicados, de forma direta, na articulação das linguagens.
Os nervos sensitivos e os vasos sanguíneos do centro de qualquer dente estão protegidos por várias camadas de tecido. A mais externa, o esmalte, é a substância mais dura. Sob o esmalte, circulando a polpa, da coroa até a raiz, está situada uma camada de substância óssea chamada dentina. A cavidade polpar é ocupada pela polpa dental, um tecido conjuntivo frouxo, ricamente vascularizado e inervado. Um tecido duro chamado cemento separa a raiz do ligamento peridental, que prende a raiz e liga o dente à gengiva e à mandíbula, na estrutura e composição química assemelha-se ao osso; dispõe-se como uma fina camada sobre as raízes dos dentes. Através de um orifício aberto na extremidade da raiz, penetram vasos sanguíneos, nervos e tecido conjuntivo.

: : : dentes : : :
Idades em que normalmente aparecem os dentes
Dentição de Leite Idade
Incisivos centrais inferiores
Incisivos superiores
Incisivos laterais inferiores
Primeiros molares
Caninos
Segundos molares 6 a 9 meses
8 a 10 meses
15 a 21 meses
15 a 21 meses
16 a 20 meses
20 a 24 meses
Dentição Permanente Idade
Primeiros molares
Incisivos centrais
Incisivos laterais
Primeiros pré-molares
Segundos pré-molares
Caninos
Segundos molares
Dentes do siso 6 anos
7 anos
8 anos
9 anos
10 anos
entre 11 e 12 anos
entre 12 e 13 anos
entre 15 e 25 anos
Doença da Cárie
Os dentes são suscetíveis a um processo de putrefação (cárie dental). A bactéria acidogênica oral, que está sempre presente na boca, reage com os carboidratos para formar ácidos capazes de dissolver o esmalte, permitindo a penetração de outras bactérias na dentina. Com o tempo, a cárie provoca uma cavidade na estrutura do dente.
Devemos nos lembrar que para qualquer tipo de doença, a prevenção é o melhor remédio, e isto é válido também para se evitar a doença da cárie dental. Uma deficiente escovação dos dentes leva à formação de placas, que ficam grudadas nos dentes, mais normalmente ao nível da gengiva e dos dentes.
No início das doenças da cárie e gengiva o tratamento é simples e rápido, mas se deixado de lado pode-se ter graves quadros de doenças periodontais e cáries cada vez maiores, que chegam a destruir quase todo o dente, sendo necessário um tratamento de canal, quando senão a perda total do dente. Ocorrendo a perda do dente, tem que recorrer ao processo de prótese para restaurar o sorriso perdido, prótese esta que poderá ser fixa, móvel ou implantes dentários. No tratamento, os padrões de cores dos materiais restauradores são tão variados que pode-se restaurar um dente sem ser percebida, tamanha semelhança com os dentes naturais.
O tratamento dentário atual é completamente indolor e muito confortável. Tratando com a maior tranqüilidade, restaurando sua saúde dental.
Um perfeito hábito de escovar os dentes após qualquer tipo de refeição, uma consulta periódica de 6 em 6 meses com seu dentista é de suma importância, e são os melhores métodos para impedir o aparecimento e evolução da doença da cárie.
Doença das Gengivas
A Doença das Gengivas ou Doença Periodontal se inicia da mesma forma que a cárie, ou seja, com a formação da placa bacteriana. A placa bacteriana fica aderida ao dente e ataca as gengivas, provocando inflamação. Então, a gengiva fica bastante vermelha, inchada e pode sangrar. É a chamada Gengivite.
Atenção: A gengivite pode ser resolvida, em muitos casos, através de uma escovação correta e do uso do fio dental. A partir do aparecimento de cálculo, a Doença Periodontal deve ser tratada pelo dentista, que deve ser procurado também caso haja alguma região da gengiva que apresente sangramento com freqüência, apesar de uma boa escovação.

: : : dentes : : :
Idades em que normalmente aparecem os dentes
Dentição de Leite Idade
Incisivos centrais inferiores
Incisivos superiores
Incisivos laterais inferiores
Primeiros molares
Caninos
Segundos molares 6 a 9 meses
8 a 10 meses
15 a 21 meses
15 a 21 meses
16 a 20 meses
20 a 24 meses
Dentição Permanente Idade
Primeiros molares
Incisivos centrais
Incisivos laterais
Primeiros pré-molares
Segundos pré-molares
Caninos
Segundos molares
Dentes do siso 6 anos
7 anos
8 anos
9 anos
10 anos
entre 11 e 12 anos
entre 12 e 13 anos
entre 15 e 25 anos
Doença da Cárie
Os dentes são suscetíveis a um processo de putrefação (cárie dental). A bactéria acidogênica oral, que está sempre presente na boca, reage com os carboidratos para formar ácidos capazes de dissolver o esmalte, permitindo a penetração de outras bactérias na dentina. Com o tempo, a cárie provoca uma cavidade na estrutura do dente.
Devemos nos lembrar que para qualquer tipo de doença, a prevenção é o melhor remédio, e isto é válido também para se evitar a doença da cárie dental. Uma deficiente escovação dos dentes leva à formação de placas, que ficam grudadas nos dentes, mais normalmente ao nível da gengiva e dos dentes.
No início das doenças da cárie e gengiva o tratamento é simples e rápido, mas se deixado de lado pode-se ter graves quadros de doenças periodontais e cáries cada vez maiores, que chegam a destruir quase todo o dente, sendo necessário um tratamento de canal, quando senão a perda total do dente. Ocorrendo a perda do dente, tem que recorrer ao processo de prótese para restaurar o sorriso perdido, prótese esta que poderá ser fixa, móvel ou implantes dentários. No tratamento, os padrões de cores dos materiais restauradores são tão variados que pode-se restaurar um dente sem ser percebida, tamanha semelhança com os dentes naturais.
O tratamento dentário atual é completamente indolor e muito confortável. Tratando com a maior tranqüilidade, restaurando sua saúde dental.
Um perfeito hábito de escovar os dentes após qualquer tipo de refeição, uma consulta periódica de 6 em 6 meses com seu dentista é de suma importância, e são os melhores métodos para impedir o aparecimento e evolução da doença da cárie.
Doença das Gengivas
A Doença das Gengivas ou Doença Periodontal se inicia da mesma forma que a cárie, ou seja, com a formação da placa bacteriana. A placa bacteriana fica aderida ao dente e ataca as gengivas, provocando inflamação. Então, a gengiva fica bastante vermelha, inchada e pode sangrar. É a chamada Gengivite.
Atenção: A gengivite pode ser resolvida, em muitos casos, através de uma escovação correta e do uso do fio dental. A partir do aparecimento de cálculo, a Doença Periodontal deve ser tratada pelo dentista, que deve ser procurado também caso haja alguma região da gengiva que apresente sangramento com freqüência, apesar de uma boa escovação.
fonte: colaweb.com
Características dos dentes
Os dentes são estruturas duras, calcificadas, presas aos maxilares superior e inferior, cuja atividade principal é a mastigação. Estão implicados, de forma direta, na articulação das linguagens.
Os nervos sensitivos e os vasos sanguíneos do centro de qualquer dente estão protegidos por várias camadas de tecido. A mais externa, o esmalte, é a substância mais dura. Sob o esmalte, circulando a polpa, da coroa até a raiz, está situada uma camada de substância óssea chamada dentina. A cavidade polpar é ocupada pela polpa dental, um tecido conjuntivo frouxo, ricamente vascularizado e inervado. Um tecido duro chamado cemento separa a raiz do ligamento peridental, que prende a raiz e liga o dente à gengiva e à mandíbula, na estrutura e composição química assemelha-se ao osso; dispõe-se como uma fina camada sobre as raízes dos dentes. Através de um orifício aberto na extremidade da raiz, penetram vasos sanguíneos, nervos e tecido conjuntivo.

: : : dentes : : :
Idades em que normalmente aparecem os dentes
Dentição de Leite Idade
Incisivos centrais inferiores
Incisivos superiores
Incisivos laterais inferiores
Primeiros molares
Caninos
Segundos molares 6 a 9 meses
8 a 10 meses
15 a 21 meses
15 a 21 meses
16 a 20 meses
20 a 24 meses
Dentição Permanente Idade
Primeiros molares
Incisivos centrais
Incisivos laterais
Primeiros pré-molares
Segundos pré-molares
Caninos
Segundos molares
Dentes do siso 6 anos
7 anos
8 anos
9 anos
10 anos
entre 11 e 12 anos
entre 12 e 13 anos
entre 15 e 25 anos
Doença da Cárie
Os dentes são suscetíveis a um processo de putrefação (cárie dental). A bactéria acidogênica oral, que está sempre presente na boca, reage com os carboidratos para formar ácidos capazes de dissolver o esmalte, permitindo a penetração de outras bactérias na dentina. Com o tempo, a cárie provoca uma cavidade na estrutura do dente.
Devemos nos lembrar que para qualquer tipo de doença, a prevenção é o melhor remédio, e isto é válido também para se evitar a doença da cárie dental. Uma deficiente escovação dos dentes leva à formação de placas, que ficam grudadas nos dentes, mais normalmente ao nível da gengiva e dos dentes.
No início das doenças da cárie e gengiva o tratamento é simples e rápido, mas se deixado de lado pode-se ter graves quadros de doenças periodontais e cáries cada vez maiores, que chegam a destruir quase todo o dente, sendo necessário um tratamento de canal, quando senão a perda total do dente. Ocorrendo a perda do dente, tem que recorrer ao processo de prótese para restaurar o sorriso perdido, prótese esta que poderá ser fixa, móvel ou implantes dentários. No tratamento, os padrões de cores dos materiais restauradores são tão variados que pode-se restaurar um dente sem ser percebida, tamanha semelhança com os dentes naturais.
O tratamento dentário atual é completamente indolor e muito confortável. Tratando com a maior tranqüilidade, restaurando sua saúde dental.
Um perfeito hábito de escovar os dentes após qualquer tipo de refeição, uma consulta periódica de 6 em 6 meses com seu dentista é de suma importância, e são os melhores métodos para impedir o aparecimento e evolução da doença da cárie.
Doença das Gengivas
A Doença das Gengivas ou Doença Periodontal se inicia da mesma forma que a cárie, ou seja, com a formação da placa bacteriana. A placa bacteriana fica aderida ao dente e ataca as gengivas, provocando inflamação. Então, a gengiva fica bastante vermelha, inchada e pode sangrar. É a chamada Gengivite.
Atenção: A gengivite pode ser resolvida, em muitos casos, através de uma escovação correta e do uso do fio dental. A partir do aparecimento de cálculo, a Doença Periodontal deve ser tratada pelo dentista, que deve ser procurado também caso haja alguma região da gengiva que apresente sangramento com freqüência, apesar de uma boa escovação.

: : : dentes : : :
Idades em que normalmente aparecem os dentes
Dentição de Leite Idade
Incisivos centrais inferiores
Incisivos superiores
Incisivos laterais inferiores
Primeiros molares
Caninos
Segundos molares 6 a 9 meses
8 a 10 meses
15 a 21 meses
15 a 21 meses
16 a 20 meses
20 a 24 meses
Dentição Permanente Idade
Primeiros molares
Incisivos centrais
Incisivos laterais
Primeiros pré-molares
Segundos pré-molares
Caninos
Segundos molares
Dentes do siso 6 anos
7 anos
8 anos
9 anos
10 anos
entre 11 e 12 anos
entre 12 e 13 anos
entre 15 e 25 anos
Doença da Cárie
Os dentes são suscetíveis a um processo de putrefação (cárie dental). A bactéria acidogênica oral, que está sempre presente na boca, reage com os carboidratos para formar ácidos capazes de dissolver o esmalte, permitindo a penetração de outras bactérias na dentina. Com o tempo, a cárie provoca uma cavidade na estrutura do dente.
Devemos nos lembrar que para qualquer tipo de doença, a prevenção é o melhor remédio, e isto é válido também para se evitar a doença da cárie dental. Uma deficiente escovação dos dentes leva à formação de placas, que ficam grudadas nos dentes, mais normalmente ao nível da gengiva e dos dentes.
No início das doenças da cárie e gengiva o tratamento é simples e rápido, mas se deixado de lado pode-se ter graves quadros de doenças periodontais e cáries cada vez maiores, que chegam a destruir quase todo o dente, sendo necessário um tratamento de canal, quando senão a perda total do dente. Ocorrendo a perda do dente, tem que recorrer ao processo de prótese para restaurar o sorriso perdido, prótese esta que poderá ser fixa, móvel ou implantes dentários. No tratamento, os padrões de cores dos materiais restauradores são tão variados que pode-se restaurar um dente sem ser percebida, tamanha semelhança com os dentes naturais.
O tratamento dentário atual é completamente indolor e muito confortável. Tratando com a maior tranqüilidade, restaurando sua saúde dental.
Um perfeito hábito de escovar os dentes após qualquer tipo de refeição, uma consulta periódica de 6 em 6 meses com seu dentista é de suma importância, e são os melhores métodos para impedir o aparecimento e evolução da doença da cárie.
Doença das Gengivas
A Doença das Gengivas ou Doença Periodontal se inicia da mesma forma que a cárie, ou seja, com a formação da placa bacteriana. A placa bacteriana fica aderida ao dente e ataca as gengivas, provocando inflamação. Então, a gengiva fica bastante vermelha, inchada e pode sangrar. É a chamada Gengivite.
Atenção: A gengivite pode ser resolvida, em muitos casos, através de uma escovação correta e do uso do fio dental. A partir do aparecimento de cálculo, a Doença Periodontal deve ser tratada pelo dentista, que deve ser procurado também caso haja alguma região da gengiva que apresente sangramento com freqüência, apesar de uma boa escovação.
fonte: colaweb.com
Introdução ao estudo dos conjuntos
Colégio Estadual Dinah Gonçalves
email accbarroso@hotmail.com
Teoria de conjuntos
Os conjuntos são representados sempre por uma letra maiúscula do alfabeto e podem ser expressos das seguintes formas:
1. Por extenso: A = {6, 8, 10, 12, 14}
2. Por descrição: B = {x: x é um número ímpar maior que 7} → lê-se: B é um conjunto formado por elementos x, tal que x é um número ímpar maior que 7.
3. Pelo diagrama de Venn-Euler:
1. Conjunto Infinito
A = {x: x é um número par} = {0, 2, 4, 6, 8, 10, 12, 14, 16, ...}
2. Conjunto Finito
B = {x: x é um número par menor que 11} = {0, 2, 4, 6, 8, 10}
3. Conjunto Unitário
C = {x: x é um número primo e par} = {2}
4. Conjunto Vazio
D = {x: x é um número primo menor que 2} = { } = ø
Relação de pertinência
A relação de pertinência é utilizada para determinar se um elemento pertence ou não a um determinado conjunto. Para isso utilizamos os símbolos:
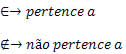
Exemplo 1: Dado o conjunto A = {5, 9, 13, 17, 21, 25, 29}, temos que:

A relação de pertinência é utilizada somente para comparação de elemento com conjunto.
Relação de inclusão
A relação de inclusão é utilizada para verificar se um conjunto está ou não contido em outro, ou seja, se um é subconjunto do outro, utilizando para isso os símbolos:

Dizemos que um conjunto A está contido num conjunto B quando todos os elementos de A pertencem também a B.
Exemplo 2: Dados os conjuntos A = {1, 2, 3, 4}, B = {3, 4, 5, 6, 7} e C = {0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10}, podemos dizer que:

Quando ocorrer de
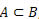 , dizemos que A é um subconjunto de B.
, dizemos que A é um subconjunto de B.Produto Cartesiano
Dados dois conjuntos A e B, define-se produto cartesiano, representado por A x B (lê-se A cartesiano B), como sendo o conjunto de todos os pares ordenados (x, y) onde os valores de x são compostos por elementos do conjunto A e os valores de y compostos por elementos do conjunto B.
Exemplo 3: Seja A = {2, 4, 6, 8} e B = {1, 3, 5}, temos que:
A x B = {(2, 1), (2, 3), (2, 5), (4, 1), (4, 3), (4, 5), (6, 1), (6, 3), (6, 5), (8, 1), (8, 3), (8, 5)}
Note que B x A é diferente de A x B:
B x A = {(1, 2), (1, 4), (1, 6), (1, 8), (3, 2), (3, 4), (3, 6), (3, 8), (5, 2), (5, 4), (5, 6), (5, 8)}
Exemplo 4: Sendo A = {m, n, p} e B = {10, 11}, temos que:
A x B = {(m, 10), (m, 11), (n, 10), (n, 11), (p, 10), (p, 11)}
B x A = {(10, m), (10, n), (10, p), (11, m), (11, n), (11, p)}
Marcelo Rigonatto
Retículo Endoplasmático

Colégio Estadual Dinah Gonçalves
email accbarroso@hotmail.com
O retículo endoplasmático é um aglomerado de membranas que evolvem cavidades de várias formas. Tais cavidades ficam separadas do citosol pela membrana e no seu interior ocorrem a síntese e o transporte de várias substâncias. As membranas constituem às vezes túbulos, e outras vezes sacos achatados. São conhecidos dois tipos de retículos: O retículo endoplasmático liso e o retículo endoplasmático rugoso.
Retículo Endoplasmático Rugoso (RER)
Também denominado de gastoplasma, é formado por cavidades achatadas com vários ribossomos na parte externa da membrana, ou seja, na parte em contato com o citoplasma. A presença dos ribossomos dá característica enrugada à membrana quando observada ao microscópio. As proteínas produzidas pelos ribossomos do retículo rugoso são lançadas na cavidade do retículo e envolvidas por pedaços de membrana, formando pequenos “pacotes” ou vesículas cheias de proteína. Esses pequenos “pacotes” são enviados para o complexo golgiense, de onde podem ser secretadas, ou seja, lançadas para fora da célula. Dessa forma defini-se que o retículo endoplasmático rugoso produz proteínas para exportação. Porém o retículo rugoso também produz proteínas que, depois de chegarem ao complexo golgiense, serão transferidas para a membrana plasmática ou para outra organela do sistema de endomembranas. Dessa forma, o retículo endoplasmático rugoso também produz proteínas que formam membranas.
Retículo Endoplasmático Liso (REL)
Constituí cavidades em forma de tubos e não possui ribossomos aderidos às suas membranas, portanto, não atua na síntese de proteínas. Porém em poucas cavidades há enzimas que sintetizam diversos tipos de lipídios, como os da membrana plasmática e os esteróides (que formam, por exemplo, os hormônios sexuais). Existem também enzimas responsáveis por uma desintoxicação do organismo, enzimas que transportam alguns medicamentos, álcool e outras substâncias tóxicas em produtos menos tóxicos e de excreção mais simples. Tal processo é realizado no fígado, na pele, nos rins e nos pulmões. Nos músculos, o retículo endoplasmático liso (conhecido como retículo sarcoplasmático) também é muito desenvolvido e serve de reservatório de íons, cálcio necessário ao mecanismo de contração.
Doação de medula óssea

É retirada uma pequena quantidade de medula óssea do doador.
A medula óssea, localizada na cavidade interna de alguns ossos, é responsável pela fabricação de hemácias, glóbulos brancos e plaquetas de nosso corpo; a partir de células-mães. Assim, pessoas cuja medula está com seu funcionamento comprometido - seja por doenças genéticas hereditárias, autoimunes ou hematológicas, imunodeficiências e tumores – podem necessitar de transplante deste material, quando o tratamento quimio e radioterápico não estão sendo eficazes.
Para o transplante, a medula do paciente recebe altas doses de quimioterapia e/ou radioterapia, a fim de destruí-la, e também para que seu organismo não reconheça a nova medula como um corpo estranho. Neste momento, o indivíduo pode ter como efeitos colaterais: náuseas, vômitos, perda de apetite, surgimento de feridas nas mucosas, mau funcionamento intestinal ou queda de cabelos.
As células da medula sadia são implantadas via transfusão sanguínea, por meio do cateter venoso, instalado em uma veia de grande calibre do paciente. É também por este que o paciente recebe a quimioterapia e medicamentos.
As células sadias se instalam, posteriormente, no interior dos ossos, e lá se multiplicam e se diferenciam em células sanguíneas. Até estabelecer um equilíbrio ótimo destas células, o transplantado deve ingerir antibióticos, para evitar infecções, e receber doações de sangue compatível.
Para o transplante, o doador pode ser o próprio paciente (transplante autólogo), em alguns casos de leucemia, onde a medula é retirada antes da quimioterapia; um irmão gêmeo idêntico (singênico); ou algum doador compatível (alogênico), que pode ser pais, irmãos, ou mesmo doadores voluntários. Para este último caso, há 35% e 0,1% de chances, respectivamente, de se achar doadores nestas condições.
Para ser um doador voluntário, é necessário que tenha entre 18 e 55 anos e bom estado de saúde. Este deverá ser previamente cadastrado, doando uma amostra de sangue para verificação de compatibilidade: informação esta que será disponibilizada em banco de dados. Quando encontrado algum paciente compatível, o doador é solicitado, podendo fornecer a medula em centros de transplante de sua própria cidade.
Para tal, pode ser feita punção de veia periférica, com retirada de algumas células sanguíneas por meio de um aparelho semelhante ao utilizado em hemodiálises; ou punção feita diretamente do osso do quadril, por meio de seringas. Neste segundo caso, o doador recebe anestesia.
Poucos dias após a doação, a medula do voluntário é completamente regenerada. Este procedimento é simples, não oferece riscos de complicações a ele, e pode salvar vidas.
Observação: O presidente Lula sancionou uma lei, publicada no Diário Oficial da União no dia 23.04.09, que institui a Semana de Mobilização Nacional para Doadores de Medula Óssea. Esta ocorrerá todos os anos, entre 14 e 21 de dezembro.
Para o transplante, a medula do paciente recebe altas doses de quimioterapia e/ou radioterapia, a fim de destruí-la, e também para que seu organismo não reconheça a nova medula como um corpo estranho. Neste momento, o indivíduo pode ter como efeitos colaterais: náuseas, vômitos, perda de apetite, surgimento de feridas nas mucosas, mau funcionamento intestinal ou queda de cabelos.
As células da medula sadia são implantadas via transfusão sanguínea, por meio do cateter venoso, instalado em uma veia de grande calibre do paciente. É também por este que o paciente recebe a quimioterapia e medicamentos.
As células sadias se instalam, posteriormente, no interior dos ossos, e lá se multiplicam e se diferenciam em células sanguíneas. Até estabelecer um equilíbrio ótimo destas células, o transplantado deve ingerir antibióticos, para evitar infecções, e receber doações de sangue compatível.
Para o transplante, o doador pode ser o próprio paciente (transplante autólogo), em alguns casos de leucemia, onde a medula é retirada antes da quimioterapia; um irmão gêmeo idêntico (singênico); ou algum doador compatível (alogênico), que pode ser pais, irmãos, ou mesmo doadores voluntários. Para este último caso, há 35% e 0,1% de chances, respectivamente, de se achar doadores nestas condições.
Para ser um doador voluntário, é necessário que tenha entre 18 e 55 anos e bom estado de saúde. Este deverá ser previamente cadastrado, doando uma amostra de sangue para verificação de compatibilidade: informação esta que será disponibilizada em banco de dados. Quando encontrado algum paciente compatível, o doador é solicitado, podendo fornecer a medula em centros de transplante de sua própria cidade.
Para tal, pode ser feita punção de veia periférica, com retirada de algumas células sanguíneas por meio de um aparelho semelhante ao utilizado em hemodiálises; ou punção feita diretamente do osso do quadril, por meio de seringas. Neste segundo caso, o doador recebe anestesia.
Poucos dias após a doação, a medula do voluntário é completamente regenerada. Este procedimento é simples, não oferece riscos de complicações a ele, e pode salvar vidas.
Observação: O presidente Lula sancionou uma lei, publicada no Diário Oficial da União no dia 23.04.09, que institui a Semana de Mobilização Nacional para Doadores de Medula Óssea. Esta ocorrerá todos os anos, entre 14 e 21 de dezembro.
Por Mariana Araguaia
Graduada em Biologia
Graduada em Biologia
Assinar:
Postagens (Atom)