Professor de Matemática no Colégio Estadual Dinah Gonçalves
E Biologia na rede privada de Salvador-Bahia
Professor Antonio Carlos carneiro Barroso
email accbarroso@hotmail.com
Sistemas de Equações
Por Marcos Noé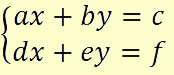
Sistema linear
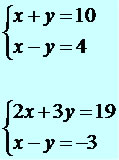
Método da Substituição
O método da substituição consiste em trabalhar qualquer equação do sistema de forma a isolar uma das incógnitas, substituindo o valor isolado na outra equação. Observe passo a passo a resolução do sistema a seguir:
O método da substituição consiste em trabalhar qualquer equação do sistema de forma a isolar uma das incógnitas, substituindo o valor isolado na outra equação. Observe passo a passo a resolução do sistema a seguir:
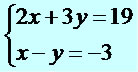
Nesse caso, vamos escolher a 2º equação e isolar a incógnita x.
x – y = –3
x = –3 + y
Agora, substituímos o valor de x por –3 + y na 1º equação.
2x + 3y = 19
2*(–3 + y) + 3y = 19
–6 + 2y + 3y = 19
2y + 3y = 19 + 6
5y = 25
y = 5
Para finalizar, calculamos o valor de x utilizando a seguinte equação:
x = –3 + y
x = –3 + 5
x = 2
Portanto, a solução do sistema é x = 2 e y = 5, isto é, o par ordenado (2,5)
Método da Adição
O método da adição deve ser utilizado nos sistemas em que existe a oportunidade de zerar uma das incógnitas. Observe a resolução do sistema a seguir:
x – y = –3
x = –3 + y
Agora, substituímos o valor de x por –3 + y na 1º equação.
2x + 3y = 19
2*(–3 + y) + 3y = 19
–6 + 2y + 3y = 19
2y + 3y = 19 + 6
5y = 25
y = 5
Para finalizar, calculamos o valor de x utilizando a seguinte equação:
x = –3 + y
x = –3 + 5
x = 2
Portanto, a solução do sistema é x = 2 e y = 5, isto é, o par ordenado (2,5)
Método da Adição
O método da adição deve ser utilizado nos sistemas em que existe a oportunidade de zerar uma das incógnitas. Observe a resolução do sistema a seguir:
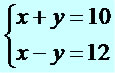
1º passo: somamos as equações, eliminando uma das incógnitas e determinando o valor da outra incógnita.
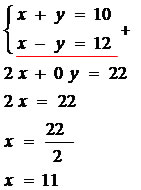
Calculado o valor de x, basta escolher uma das equações e substituir o valor de x por 11.
x + y = 10
y = 10 – x
y = 10 – 11
y = –1
A solução do sistema é o par ordenado (11, –1).
x + y = 10
y = 10 – x
y = 10 – 11
y = –1
A solução do sistema é o par ordenado (11, –1).


