Esse é o blog do Professor de Matemática Carlos Barroso. Trabalho no Colégio Estadual Dinah Gonçalves . Valéria-Salvador-Bahia .Inscreva-se Já no meu canal www.youtube.com/accbarroso1 e receba as videoaulas de Matemática.
sábado, 26 de outubro de 2019
Energias alternativas O que fazer quando o petróleo acabar?

Usina nuclear de Angra dos Reis (RJ)
Fala-se no colapso de nossa civilização do petróleo desde a primeira crise de 1973, quando os preços internacionais do óleo cru dobraram. O conteúdo das discussões variava então dos alertas sobre a necessidade urgente de se descobrirem fontes alternativas de energia ao catastrofismo dos que previam para as próximas décadas um penoso retorno da humanidade ao modo de vida da Idade Média.
Como o assunto nunca mais saiu da moda, até hoje assistimos a apresentação das últimas descobertas quanto à substituição do petróleo, sendo alguns projetos tão mirabolantes que parecem tirados da literatura de ficção científica.
A realidade é bem menos glamurosa, e também, felizmente, menos preocupante. As reservas de petróleo atualmente comprovadas devem durar pelo menos mais 50 anos, sendo interessante lembrar que os preços internacionais do petróleo variam de modo inversamente proporcional às estimativas destas reservas comprovadas, razão para os países produtores serem modestos quanto a tais estimativas.
Além disto, o planeta é grande o bastante para que sempre seja possível a descoberta de novas grandes jazidas, que podem adiar o esgotamento dos poços para o próximo século ou mesmo além.
Energias alternativas ao petróleo
Para a decepção dos que alimentam a esperança de comprar um automóvel movido a antigravidade ou coisa parecida, as soluções mais viáveis para substituição do petróleo já estão disponíveis e a maioria delas é conhecida há mais de 50 anos. O desafio da substituição do petróleo está em se desenvolver fontes alternativas razoavelmente abundantes, baratas e ambientalmente seguras para:
* Acionar centrais térmicas para produção de energia elétrica;
* Prover combustíveis industriais;
* Prover combustíveis automotivos;
* Prover matérias primas derivadas para a petroquímica.
As opções atualmente consideradas mais viáveis para suprir estas necessidades passam longe de qualquer solução miraculosa, a começar do fato de o substituto imediato mais provável para o petróleo ser o petróleo.
Não há erro de digitação no parágrafo acima. Quando se fala em esgotamento das reservas de petróleo, o assunto quase sempre se refere ao óleo cru convencional, extraído por bombeamento dos leitos rochosos.
Petróleo não convencional
Pouco se fala sobre as formas não convencionais de petróleo, as areias e xistos betuminosos, de mais difícil obtenção e refino que o petróleo convencional, mas que são economicamente viáveis para exploração em larga escala quando o petróleo convencional escassear.
Considerados as areias e xistos betuminosos, as reservas de petróleo mundiais, convencional e não convencional, mais do que dobrariam, o que nos níveis atuais de consumo garante o prolongamento da era do petróleo até o século 22, pelo menos.
Além disto, quando se fala das reservas de petróleo, geralmente não se somam os números relativos às reservas de gás natural, cuja prospecção, produção e utilização mundial cresceram muito desde a primeira crise do petróleo, ao ponto de rivalizar com ele em uma série de aplicações.
Gás natural
A recente crise entre o Brasil e a Bolívia se dá pelo fato de o gás natural ser hoje o principal propulsor da indústria paulista, que passou a utilizar o gás em quase todos os seus queimadores de caldeiras antigamente movidos a óleo combustível BPF, derivado do petróleo.
O gás natural também é o substituto mais viável para a nafta, derivado do petróleo que é transformado nas centrais petroquímicas responsáveis pela produção das chamadas olefinas - etileno, propileno e butadieno - matérias primas dos polímeros sintéticos, os plásticos tão presentes e necessários no nosso dia a dia.
E já que falamos em plásticos, todo mundo conhece o álcool e o biodiesel como combustíveis alternativos genuinamente brasileiros. É interessante lembrar que o etanol e os óleos vegetais também podem ser utilizados na fabricação de plásticos.
Gasolina sintética
Outro alternativa ao petróleo, conhecido e usado desde a Segunda Guerra Mundial é a gasolina sintética ou nafta sintética, que pode ser utilizada tanto como combustível como matéria prima petroquímica na obtenção de plásticos e outros produtos da cadeia de transformação de petróleo.
A gasolina sintética pode ser obtida do carvão, o qual, por falar nele, também é um combustível substituto barato e abundante. Como vimos até aqui, a maioria das funções desempenhadas hoje pelo petróleo podem ser substituídas por outros hidrocarbonetos minerais ou similares de origem vegetal.
Mas há uma outra alternativa energética já tida como economicamente viável, a dobradinha hidrogênio/energia nuclear. Quando a energia nuclear foi revelada ao mundo em 1945, junto com o assombro com a explosão em Hiroshima, veio a esperança de que aquela revolucionária fonte de energia resolveria todos os problemas da humanidade.
Energia nuclear
Alguns livros de ficção científica da década de 1950 previam um futuro próximo onde até os cinzeiros domésticos disporiam de artefatos nucleares que desintegrariam as cinzas dos cigarros ao invés de simplesmente coletá-los.
Ao longo da segunda metade do século 20 a produção de energia nuclear passou a sofrer forte oposição política, que a acusava de ser cara, perigosa e suja, o que inibiu uma visão de futuro em que as usinas atômicas fossem a principal fonte de geração de energia.
Na verdade, o uso disseminado da energia atômica só é perigoso do ponto de vista militar, uma vez que pode permitir a proliferação das armas nucleares entre governos não confiáveis pelo mundo afora.
Fora isto, o custo do kWh atômico é mais caro que o obtido pela queima de combustíveis fósseis ou por hidrelétricas, mas é mais barato que a maioria das outras fontes alternativas e completamente viável do ponto de vista econômico.
Segurança e lixo atômico
Quanto aos riscos ao meio ambiente, o lixo atômico gerado pelas centrais nucleares é contado em quilos, enquanto os resíduos provenientes da queima de combustíveis fósseis são da ordem de milhões de toneladas.
Quanto à segurança das operações nucleares, é possível traçar uma analogia com a aviação, que é sabidamente segura, mas onde os raros acidentes geram desastres de grandes proporções e comoção geral, como foi o caso de Chernobyl, na Ucrânia, então parte da antiga União Soviética.
Hidrogênio
Do ponto de vista técnico, a opção nuclear por si só já estaria no páreo dos substitutos do petróleo para a produção de energia elétrica. Esta posição é reforçada pelos novos projetos para obtenção de hidrogênio a partir do uso da energia nuclear.
O hidrogênio é a substância mais abundante do universo e um combustível limpo que produz como resíduo apenas água. Seria a melhor opção como fonte energética se não fosse o fato de que ele só se encontra disponível na natureza na forma de compostos, como a água, por exemplo.
Podemos obter H2 a partir da hidrólise da água, mas isto demanda grandes quantidades de energia na forma de calor para romper as ligações moleculares com o oxigênio, o que inviabilizava o processo por muitas vias convencionais tentadas.
Como as fissões nucleares podem fornecer calor praticamente ilimitado, seu aproveitamento na obtenção de hidrogênio representa uma das opções mais baratas para a obtenção deste combustível que no futuro poderá ser usado em larga escala nos veículos automotores. Isto se os automóveis elétricos não ganharem a corrida das tecnologias alternativas para o motor a combustão, um velhinho com mais de cem anos.
Transição civilizada
Por tudo isto, considerados apenas as tecnologias já dominadas e os recursos já disponíveis, o mundo pode administrar uma transição da civilização do petróleo para um outro modelo de uma forma muito gradual, sem grandes choques ou rupturas.
Se colocarmos na equação todas as possibilidades ainda por descobrir e desenvolver, as expectativas se tornam ainda maiores.
Os catastrofistas que me desculpem, mas o melhor modo que encontro de representar esta transição é parafraseando T. S. Elliot: A era do petróleo não terminará com um estrondo, mas com um suspiro.
*Carlos Roberto de Lana é engenheiro químico e professor.
Conjunto
Colégio Estadual Dinah Gonçalves
email accbarroso@hotmail.com
Relação de pertinência
Cada aluno da classe tem uma mesma propriedade: estar na sala de aula. Assim, ao falarmos neste conjunto estabelecemos a possibilidade de averiguar se uma pessoa pertence ou não a ele. O conceito básico da teoria dos conjuntos é a relação de pertinência representada pelo símbolo . As letras minúsculas designam os elementos de um conjunto e as maiúsculas, os conjuntos. Assim, o conjunto das vogais (V) é:
V = {a, e, i, o, u}
• A relação de pertinência é expressa por: a V, pois o elemento a pertence ao conjunto V.
• A relação de não-pertinência é expressa por: bV, pois o elemento b não pertence ao conjunto V.
Figura 2
Representação de um conjunto
Para representar um conjunto pode-se escrever, entre chaves, todos os elementos que pertencem ao conjunto, como foi demonstrado anteriormente o conjunto V, ou então expressá-lo graficamente com um diagrama de Venn. Os conjuntos são representados por curvas fechadas e, em seu interior, os elementos, por pontos (Figura 2).
Formação de um conjunto
Um conjunto pode ser definido de duas maneiras:
• Enumerando todos os elementos do conjunto:
S = {1, 3, 5, 7, 9}
• Expressando uma ou mais propriedades que se verificam para todos os seus elementos e somente para eles:
S = {números ímpares de um algarismo} Podemos representá-lo assim:
B = {x S | x tem a propriedade P}; (lê-se: x pertence ao conjunto S tal que x possui a propriedade P).
O conjunto B é formado por todos os elementos de S que possuem a propriedade P.
Exemplo:
Sendo N o conjunto dos números naturais:
B = {xN | x < 8}
Enumerando-se os elementos de B temos:
B = {0, 1, 2, 3, 4, 5, 6, 7}
Conjunto vazio
É aquele que não contém nenhum elemento e é representado matematicamente porou por duas chaves { } em que não se escreve nada dentro.
Subconjuntos de um conjunto
Quando todos os elementos de um conjunto A pertencem também a outro conjunto B, dizemos que:
• A é um subconjunto de B
• ou então que ... A é uma parte de B
• ou então que ... A está incluído em B e escrevemos:
AB
Se existir pelo menos um elemento de A que não pertença a B, diremos então que A não está incluído em B e escreveremos:
AB
Exemplo:
Figura 3
Seja V o conjunto das vogais e L o das letras do alfabeto: VL (Figura 3, ao lado).
Conjunto das partes de um conjunto
Se tivermos um conjunto de elementos a que chamamos F, o conjunto das partes de F será aquele formado por todos os possíveis subconjuntos de F e será representado por (F).
Se o conjunto F tem n elementos, então o conjunto das partes de F, ,(F), terá 2n elementos.
Exemplo:
Sendo F = {3, 5, 9}, vamos escrever todos os possíveis subconjuntos de F:
• com nenhum elemento
• com 1 elemento {3}, {5}, {9}
• com 2 elementos {3, 5}, {3, 9}, {5, 9}
• com 3 elementos {3, 5, 9}
Podemos então escrever: (F) = {, {3}, {5}, {9}, {3, 5}, {3, 9}, {5, 9}, {3, 5, 9} }
O número de elementos de um conjunto F é denominado ordem do conjunto e é indicado por n(F).
Repare que no exemplo acima n(F) = 3 e n ((F)) = 23 = 8
Relação de inclusão
A relação de inclusão possui 3 propriedades:
Propriedade reflexiva: AA, isto é, um conjunto sempre é subconjunto dele mesmo.
Propriedade anti-simétrica: se AB e BA, então A = B.
Propriedade transitiva: se AB e BC, então AC.
Conjunto complementar
Se considerarmos o retângulo R (Figura 4, abaixo) e sua parte hachurada A, observaremos que A é um subconjunto de R.
AR
A outra parte pontilhada chama-se complementar de A com respeito a R e é representada por .
Figura 4
No caso dos alunos de uma classe, o conjunto complementar do conjunto dos alunos presentes à aula será formado pelos alunos ausentes à aula.
União e intersecção de conjuntos
Dados dois conjuntos A e B, existe sempre um terceiro formado pelos elementos que pertencem a pelo menos um dos conjuntos a que chamamos conjunto união e representamos por: AB.
Formalmente temos que: A B = {x| x A ou x B}
A união de conjuntos obedece às seguintes propriedades:
Propriedade comutativa:
A B = B A
Propriedade associativa:
A (B C) = (A B) C
Elemento Neutro:
A = A
Figura 5
Utilizando os diagramas de Venn (Figura 5, ao lado), verificamos algumas das propriedades acima.
A intersecção dos conjuntos A e B é o conjunto
formado pelos elementos que são ao mesmo
tempo de A e de B, e é representada por: A B
Formalmente temos que: A B = {x| x A e x B}
A intersecção de dois conjuntos obedece às seguintes propriedades:
Propriedade comutativa:
A B = B A
Propriedade associativa:
A (B C) = (A B) C
Propriedade de idempotência:
A A = A
Figura 6
A =
Utilizando os diagramas de Venn (Figura 6, ao lado),
podemos verificar algumas das propriedades acima.
Relacionando união e intersecção, surgem
duas outras propriedades interessantes:
Propriedade distributiva da união com relação à intersecção:
A (B C) = (A B) (A C);
Propriedade distributiva da intersecção com relação à união:
A (B C) = (A B) (A C).
Produto cartesiano
O produto cartesiano de dois conjuntos A e B, escrito A X B, é o conjunto formado por todos os pares ordenados (a, b), em que o primeiro elemento a pertence a A e o segundo elemento b pertence a B.
Simbolicamente, podemos escrever:
A X B = {(a, b)| a A, b B}
Se A = {1, 2} e B = {x, y, z}, então:
A X B = {(1, x), (1, y), (1, z), (2, x), (2, y), (2, z)}
O conjunto A X B tem 2 X 3 = 6 elementos.
Em geral, se A tem a elementos e B tem b elementos, A X B tem a X b elementos, isto é:
se n(A) = a e n(B) = b, temos que n(A X B) = a X b.
É importante salientar que os pares ordenados recebem estes nomes por se constituírem de 2 elementos em que é fundamental a ordem na qual se apresentam.
No exemplo, o par (1, x) pertence a A X B. Mas o mesmo não acontece com o par (x, 1), que pertenceria ao produto B X A.
Figura 7
É por isso que se afirma que o produto cartesiano não tem a propriedade comutativa. Ele pode ser representado de várias formas, como indica a Figura 7, ao lado:
• Com um diagrama de flechas.
• Com um diagrama cartesiano.
• Com um diagrama em árvore.
As propriedades do produto cartesiano são as seguintes:
Propriedade associativa:
(A X B) X C = A X (B X C) = A X B X C
A X =
A X B = se, e somente se, A = ou B = Se C e
A X C = B X C, então: A = B
EXERCÍCIOS
1. Enumere os conjuntos D = {dias da semana}.
2. Considerar o conjunto M.
M = {1, 3, 5, 7, 9, 11, 13, 15, 17, 19}
Que propriedade obedecem todos os elementos do conjunto M?
Expresse o conjunto M por meio da propriedade que caracteriza todos os seus elementos.
3. Determinar qual dos conjuntos seguintes está descrito pela propriedade de seus elementos e qual está com os elementos enumerados:
A = {Pessoas que receberam o Prêmio Nobel}
B = {José, Emílio, Berta, Joana, Rafael}
4. Indicar todos os subconjuntos que podem ser formados com os elementos do conjunto A.
A = {a, b, c}
5. Dados os seguintes conjuntos:
A = {1, 2, 3, 4, 5}; B = {4, 5, 6}; C = {2, 3, 4}
Calcular:
a) A B; b) A C; c) A (B C); d) (A B) C
Álcoois
Colégio Estadual Dinah Gonçalves
email accbarroso@hotmail.com
Na presença de bases fortes, os álcoois atuam como doadores. Os álcoois são geralmente ácidos ligeiramente mais fracos do que a água, com valores de pKa entre 16 e 18. Os álcoois são compostos versáteis, e podem ser usados como material de partida para a preparação de uma grande variedade de compostos.
Oxidação de álcoois a compostos carbônicos.
A oxidação de álcoois pode dar origem a um aldeído, uma cetona, ou um ácido carboxílico, dependendo do álcool, do agente oxidante e das condições da reação. Normalmente usam-se compostos de Cr (VI) como oxidantes. A reação de um álcool primário com ácido crômico (preparado por acidificação de soluções de cromato, CrO42-, ou dicromato, Cr2O72-) dá origem principalmente ao ácido carboxílico correspondente:

Para se oxidar um álcool primário apenas até ao estado de aldeído não se pode usar ácido crômico, pois este é um oxidante muito forte. Em vez deste, usam-se outras espécies de Cr (VI) (por exemplo clorocromato de piridínio - PCC - ou dicromato de piridínio - PDC) em solução anidra.

Os álcoois secundários são oxidados a cetonas pelos mesmos reagentes que oxidam os álcoois primários:

Os álcoois terciários, por não possuírem hidrogênio ligado ao carbono hidroxilado, não são facilmente oxidados.
Os álcoois podem ser classificados de duas maneiras:
De acordo com o número de hidroxilas:
* 1 hidroxila - monoálcool ou monol
* 2 hidroxilas - diálcool ou diol (também chamado glicol)
* 3 hidroxilas - triálcool ou triol
Várias hidroxilas - poliálcool ou poliol
Quanto à posição da hidroxila:
* OH em carbono primário - álcool primário
* OH em carbono secundário - álcool secundário
* OH em carbono terciário - álcool terciário.
Propriedades físicas
As moléculas dos álcoois, por possuírem o grupo polar OH, pode-se dizer, são ligadas entre si pelos mesmos tipos de forças intermoleculares que agregam as moléculas de água umas às outras - as ligações de hidrogênio. Por essa razão é possível misturar as duas substâncias. Isso, no entanto, verifica-se apenas nos álcoois mais simples (metanol, etanol e propanol). Nesses álcoois, que são líquidos incolores voláteis e de cheiro característico, o grupo OH constitui importante porção da molécula. Com o aumento da cadeia carbônica, todavia, o grupo OH começa a perder importância, pois a maior parte da molécula é um hidrocarboneto. Os álcoois então se tornam mais viscosos, menos voláteis e menos solúveis em água, até chegarmos em álcoois de massa molecular tão elevada que são sólidos e insolúveis em água. A viscosidade e a solubilidade dos álcoois em água também aumenta se o número de hidroxilas aumentar. Quanto maior o número de grupos OH, mais intensas serão as interações intermoleculares e maior serão os pontos de fusão e ebulição dos álcoois.
O etanol, em especial, quando misturado com a água na proporção de 95% de álcool e 5% de água, forma com esta uma mistura azeotrópica ou azeótropo. Isto significa que não é possível concentrar o álcool além de 95% através da destilação fracionada. Esta mistura comporta-se como um composto puro, sendo praticamente impossível separar os dois componentes. O álcool puro, chamado álcool absoluto, é muito mais caro e utiliza-se apenas quando estritamente necessário. O etanol a 95% em água tem PE = 78,15o C, inferior aos pontos de ebulição de seus componentes (etanol = 78,3o C e água = 100o C). Os azeótropos que possuem PE superior aos de seus componentes são chamados misturas de ponto de ebulição máximo.
Se o álcool a 95% não se pode concentrar mais por destilação, como é que se obtém o álcool etílico a 100% que também se encontra à venda e que se conhece por álcool absoluto? Tirando partido da existência de outra mistura azeotrópica. Esta, porém, com três componentes (azeótropo ternário). A mistura do 7,5% de água, 18,5% de etanol e 74% de benzeno é azeotrópica e tem ponto de ebulição 64,9o C (mistura de ponto de ebulição mínimo). Vejamos o que acontece se destilarmos uma mistura que contenha, por exemplo, 150 g de etanol a 95% (142,5 g de álcool e 7,5 g de água) e 74 g de benzeno. O primeiro material a destilar é o azeótropo ternário; onde destilarão 100 g, o que corresponde a 7,5 g de água, 18,5 g do álcool e 74 g do benzeno. Quer dizer, toda a água e todo o benzeno, mas apenas parte do álcool destilarão; permanecendo 124 g do álcool puro anidro. Na prática, é comum juntar-se um pouco mais de benzeno do que o estritamente necessário. O excesso é removido, depois da destilação da mistura ternária, como azeótropo binário com álcool (PE = 68,3o C). O caso do álcool etílico demonstra que os azeótropos embora, por vezes, bastante inconvenientes podem freqüentemente ser utilizados com vantagem prática. Para certos fins especiais tem de se remover mesmo o mais leve vestígio de água que possa ainda existir no álcool absoluto comercial. Consegue-se isto por tratamento do álcool com magnésio metálico; a água é transformada em Mg (OH)2 insolúvel, e o álcool é então destilado.
Métodos de obtenção
Normalmente, os álcoois não parecem livres na natureza. Entretanto, eles são muito abundantes na forma de ésteres, tanto no reino vegetal quanto no reino animal. Além disso, o álcool etílico é obtido em grande escala por processos de fermentação de açúcares.
Os principais métodos de obtenção dos álcoois são:
* Hidratação de alcenos
* Hidratação de cicloalcenos
* Oxidação branda de alcenos
* Hidratação de epóxidos
* Reação de aldeídos ou cetonas com reagente de Grignard
* Reação de éteres com HX
* Hidrólise de ésteres
Propriedades químicas
O grupo OH dos álcoois é a sua parte mais reativa, e estes compostos podem reagir de duas maneiras: rompendo a ligação O-H ou rompendo a ligação C-OH. Neste último caso, sendo o grupo OH um péssimo abandonador, ou seja, difícil de se retirar de uma molécula, geralmente utiliza-se protonar o grupamento, para facilitar a sua saída. Estudando o comportamento químico dos álcoois, pode-se conhecer muito do comportamento químico do grupo hidroxila em outros compostos.
Os álcoois funcionam como substâncias anfóteras, isto é, comportam-se às vezes como ácido e às vezes como base, ambos muito fracos. Isso vai depender principalmente da natureza do outro reagente. A acidicidade dos álcoois se deve ao fato de existir um hidrogênio ligado a um átomo muito eletronegativo, o oxigênio. O caráter ácido dos álcoois segue a seguinte ordem de intensidade: álcool primário > álcool secundário >álcool terciário. Isso ocorre por causa do efeito indutivo +I do grupo alquilo. Quanto mais radicais existirem, maior será a densidade eletrônica no oxigênio, e mais fortemente ligado estará o hidrogênio.
As principais reações dos álcoois são:
* Desidratação
* Eliminação em dióis
* Eliminação em álcoois cíclicos
* Reação com HX diluído
* Reação com HI concentrado
* Reação com cloreto de tionila
* Reação com haletos de fósforo
* Reação com ácidos (Esterificação)
* Reação com aldeídos ou cetonas
* Reação com cloretos de ácidos
Aplicações dos álcoois
Os álcoois mais simples são muito usados, dentre outras coisas, como:
* Solventes na indústria e no laboratório
* Componentes de misturas "anti-freeze” - para baixar o ponto de solidificação
* Matéria-prima de inúmeras reações para obtenção de outros compostos orgânicos
* Combustível
* Componente de bebidas (etanol)
Um diálcool (glicol) muito importante é o etileno-glicol (CH2OH - CH2OH), preparado pela oxidação do etileno por perácido. É muito usado como:
* Umectante
* "Anti-freeze" - para baixar o ponto de congelamento da água de radiadores em países frios
* Fluido em breques hidráulicos
* Matéria-prima de plásticos e fibras (poliésteres)
A glicerina (CH2OH - CHOH - CH2OH) é um triálcool de grande aplicação. Dentre os principais usos estão:
* Solventes
* Tintas
* Plastificantes
* Lubrificantes
* Agente adoçante
* Componente de cosméticos
Metanol ou álcool metílico
Líquido muito inflamável.
Ponto inflamável 4ºC (crisol fechado).
Líquido incolor, com cheiro, completamente miscível com a água.
Volátil. Ponto de ebulição 65ºC.
Os vapores são invisíveis e mais densos que o ar e formam com ele mesclas explosivas entre uns 6% e 36,5% em volume de vapor de metanol. Cuidado com os recipientes vazios que contenham resíduos.O aquecimento do recipiente origina um aumento da pressão.Perigo de estourar e explodir.
Os vapores são invisíveis e mais densos em relação ao ar .No contato com este firmam misturas explosivas.que variam de 6% até 36,5% em volume de vapor do metanol. Tomar conta dos recipientes vazios que contenham resíduos dentro.
Quando o recipiente esquentar produz incremento de pressão. Perigo de estalido e explosão!
Toxicidade
O metanol é tóxico tanto em estado líquido ou em estado de vapor. Pode ingressar ao organismo pelo nariz, boca ou pele (especialmente através de cortes ou ferimentos) e é rapidamente absorvido pelas vias sangüíneas do corpo.
Ingestão: A ingestão direta produz a resposta mais rápida, sendo 50 a 100 ml usualmente uma dose mortal, porém 25 a 50 ml são freqüentemente mortais se o paciente não é tratado imediatamente. A tolerância individual varia amplamente. Deve- se tomar todas as precauções para evitar que o metanol não seja ingerido por erro e deve ser estritamente proibido sorver com a boca.
Inalação: Altas concentrações de vapores de metanol podem produzir envenenamento agudo depois de breves exposições. Considera-se que 200 ppm de vapor de metanol em volume (0,25 mg/litro a 25ºC e 1 atm) é o limite máximo permitido na atmosfera para um trabalho de 8 horas diárias, 40 horas semanais.
Contato com a pele: O efeito imediato do metanol na pele é a perda da oleosidade e o ressecamento, típicos também de outros solventes. Contudo o metanol pode também ser absorvido pela pele e causar os efeitos tóxicos e letais descritos anteriormente.
Exposição aos olhos: Os efeitos imediatos do metanol são similares aos de outros solventes, sendo recomendado que se lave rapidamente. Através de contato direto, inalado ou ingerido, o metanol causa visão turva, uma extrema sensibilidade à luz (fotofobia) e inflamação (conjuntivite). Exposições severas podem destruir o nervo ótico, levando à cegueira e causar lesões oculares. Algumas vezes os sintomas oculares podem desaparecer inicialmente, porém retornam causando cegueira.
Etanol ou álcool etílico
Líquido incolor, com cheiro, completamente miscível com a água. Volátil. Ponto de ebulição 81ºC. Os vapores são invisíveis e mais densos que o ar e formam com ele mesclas explosivas. Cuidado com os recipientes vazios que contenham resíduos.O aquecimento do recipiente origina um aumento da pressão.¡Perigo de estourar e explodir!O líquido e seus vapores produzem irritação nos olhos, pele ou vias respiratórias. Os vapores em altas concentrações podem originar náuseas.
O etanol ou álcool etílico, apresenta duas funções principais : "commodity chemical" e indústria de bebidas alcoólicas.
Após a água, o álcool é o solvente mais comum, além de representar a matéria-prima de maior uso no laboratório e na indústria química. Na biossíntese do etanol é empregado linhagens selecionadas de Saccharomyces cerevisae, que realizam a fermentação alcoólica, a partir de um carboidrato fermentável. É muito importante que a cultura de levedura possua um crescimento vigoroso e uma elevada tolerância ao etanol, apresentando assim a fermentação um grande rendimento final. O etanol é inibidor a altas concentrações, e a tolerância das leveduras é um ponto crítico para uma produção elevada deste metabólito primário. A tolerância ao etanol varia consideravelmente de acordo com as linhagens de leveduras. De modo geral, o crescimento cessa quando a produção atinge 5% de etanol (v/v), e a taxa de produção é reduzida a zero, na concentração de 6 a 10% de etanol (v/v).
O etanol pode ser produzido a partir de qualquer carboidrato fermentável pela levedura: sacarose, sucos de frutas, milho, melaço, beterrabas, batatas, malte, cevada, aveia, centeio, arroz sorgo etc, (necessário hidrolisar os carboidratos complexos em açúcares simples fermentáveis, pelo uso de enzimas da cevada ou fúngicas, ou ainda pelo tratamento térmico do material acidificado).
Material celulósico, como madeira e resíduos da fabricação da pasta de papel podem ser utilizados. Por causa da grande quantidade de resíduos de material celulósico disponível, a fermentação direta desses materiais quando hidrolisados por enzimas celulolíticas pode ser de grande importância econômica.
Culturas mistas de Clostridium thermocellum e C. thermosaccharolyticum podem ser usadas. Hemiceluloses e celuloses são hidrolisadas em monossacarídeos (hexoses e pentoses) por essas bactérias e os monossacarídeos são fermentados diretamente a etanol.
O processo de produção de etanol:
A produção de etanol é iniciada aerobicamente para produzir o máximo de biomassa.
O etanol é produzido em três etapas principais:
* Preparação da solução nutriente;
* Fermentação;
* Destilação do etanol.
A química toxicológica
Etanol (EtOH). A toxicidade pelo etanol mostra-se relacionada à dose, mas a tolerância varia amplamente entre os indivíduos. Níveis sangüíneos maiores do que 100 mg/dl definem, em termos legais, o estado de intoxicação e estão tipicamente associados com ataxia; com 200 mg/dl, os pacientes estão sonolentos e confusos. Com níveis acima de 400 mg/dl geralmente há depressão respiratória, sendo possível à morte.Estudos laboratoriais devem incluir nível de eletrólitos, glicose, osmolalidade sérica e nível de EtOH no sangue. O nível de EtOH no sangue pode ser rapidamente estimado pelo cálculo do intervalo de osmolalidade (osmolalidade medida menos a osmolalidade calculada). O nível de álcool no sangue em miligramas/decilitro dividido por 4,3 é igual ao intervalo de osmolalidade, na ausência de outras toxinas de baixo peso molecular.
Nível de álcool no sangue = 4,3 (osmolalidade medida – osmolalidade calculada)
Álcool isopropílico (AIP). O álcool para uso externo é o AIP de 70%. Ele é mais tóxico do que o EtOH em qualquer nível sangüíneo (50 mg/dl = intoxicação, 100-200 mg/dl = estupor e coma). Depressão respiratória e hipotensão ocorrem quando os níveis sangüíneos são altos. Náusea, vômitos e dor abdominal ocorrem freqüentemente; também pode ocorrer hipoglicemia. A avaliação laboratorial comumente revela cetose sem acidose (o AIP é metabolizado até acetona). Acidose metabólica encontra-se geralmente relacionada com hipotensão associada. A concentração de AIP no sangue pode ser medida diretamente ou ser estimada da mesma maneira como o EtOH, substituindo-se o denominador 5,9 por 4,3.
Metanol (MeOH): É encontrado em líquido para limpar pára-brisas e em anticongelantes. O esterno contém tanto EtOH quanto MeOH, e o EtOH presente pode retardar as manifestações de toxicidade pelo MeOH. A toxicidade pelo MeOH é devida à sua conversão por desidrogenase alcoólica a formaldeído e ácido fórmico. EtOH retarda esse metabolismo, competindo com essa enzima. O paciente pode ter sintomas iniciais de letargia e confusão, seguidos por uma aparente "ressaca". Os sintomas tóxicos consistem de enxaqueca, sintomas visuais, náusea, vômitos, dor abdominal, taquipnéia e insuficiência respiratória. Coma e convulsões podem ocorrer em casos graves.O exame revela caracteristicamente um paciente com desconforto, que pode estar muito taquipnéico e com acuidade visual diminuída; hiperemia de disco óptico pode ser de difícil apreciação. Estudos laboratoriais devem incluir CBC, eletrólitos, BUN, creatinina, amilase, nível de EtOH, nível de MeOH, e GSAs, que irão revelar uma acidose metabólica com gap aniônico grave. A faixa de ingesta tóxica é de 15-400 ml. Em geral, o pH e o estado ácido-básico são melhores previsores da toxicidade do que o nível absoluto. O nível de MeOH em mg/dl pode ser estimado da mesma forma como o do EtOH, substituindo-se o denominador 2,6 por 4,3.
Danos causados ao organismo de quem consome muita bebida alcoólica
Para muitos brasileiros, festa é sinônimo de cerveja. Diversão, sinônimo de porre. Em alguns lugares criam-se festas de adoração à bebida alcoólica, tal como a oktoberfest em Blumenau. No supermercado, qualquer criança pode sair com litros de uma substância tóxica e entorpecente: etanol, a droga legal.
Na produção de bebidas, tal como whiskey e vodka, as impurezas é que dão o sabor diferencial.
Substratos de batatas, milho, trigo e outras plantas podem ser usados na produção do etanol por fermentação. Uma enzima, a diastase (ou maltase), converte o amido em açúcares e, então, a enzima se converte-os em álcool.
O etanol produzido por fermentação chega no máximo a 14% na solução: acima desta concentração, o etanol destrói a enzimae a fermentação pára.
O etanol pode ser concentrado por destilação, mas ocorre a formação de um azeótropo (mistura de ponto de ebulição constante) a 96% de etanol em água.
Portanto, o etanol puro não pode ser obtido por destilação. A indústria utiliza agentes desidratantes ou prepara o etanol sinteticamente, a partir de acetaldeído, que é feito através do acetileno.
Quando uma bebida alcoólica é ingerida, o etanol é absorvido no intestino delgado e distribuído pelo corpo - sendo que mais etanol é encontrado no sangue e no cérebro do que nos músculos e tecidos adiposos. O etanol é uma substância tóxica, e o organismo inicia o processo de excreção desta substância tão logo ela é consumida. Cerca de 90% é processado no fígado - a enzima álcool desidrogenase converte etanol em acetaldeído, que também é uma substância tóxica (responsável pela enxaqueca!). O aldeído é convertido a acetato, pela enzima aldeído desidroxigenase.
Autoria: Roberson Luiz
Combinações
Professor de Matemática Antonio Carlos Carneiro Barroso
Colégio Estadual Dinah Gonçalves
email accbarroso@hotmail.com
Simples
Não ocorre a repetição de qualquer elemento em cada grupo de p elementos.
Fórmula: C(m,p) = m!/[(m-p)! p!]
Cálculo para o exemplo: C(4,2)=4!/[2!2!]=24/4=6
Exemplo: Seja C={A,B,C,D}, m=4 e p=2. As combinações simples desses 4 elementos tomados 2 a 2 são 6 grupos que não podem ter a repetição de qualquer elemento nem podem aparecer na ordem trocada. Todos os agrupamentos estão no conjunto:
Cs={AB,AC,AD,BC,BD,CD}
Com repetição
Todos os elementos podem aparecer repetidos em cada grupo até p vezes.
Fórmula: Cr(m,p) = C(m+p-1,p)
Cálculo para o exemplo: Cr(4,2)=C(4+2-1,2)=C(5,2)=5!/[2!3!]=10
Exemplo: Seja C={A,B,C,D}, m=4 e p=2. As combinações com repetição desses 4 elementos tomados 2 a 2 são 10 grupos que têm todas as repetições possíveis de elementos em grupos de 2 elementos não podendo aparecer o mesmo grupo com a ordem trocada. De um modo geral neste caso, todos os agrupamentos com 2 elementos formam um conjunto com 16 elementos:
Cr={AA,AB,AC,AD,BA,BB,BC,BD,CA,CB,CC,CD,DA,DB,DC,DD}
mas para obter as combinações com repetição, deveremos excluir deste conjunto os 6 grupos que já apareceram antes, pois AB=BA, AC=CA, AD=DA, BC=CB, BD=DB e CD=DC, assim as combinações com repetição dos elementos de C tomados 2 a 2, são:
Cr={AA,AB,AC,AD,BB,BC,BD,CC,CD,DD}
----------------------------------------------------------
Regras gerais sobre a Análise Combinatória
Problemas de Análise Combinatória normalmente são muito difíceis mas eles podem ser resolvidos através de duas regras básicas: a regra da soma e a regra do produto.
Regra da soma: A regra da soma nos diz que se um elemento pode ser escolhido de m formas e um outro elemento pode ser escolhido de n formas, então a escolha de um ou outro elemento se realizará de m+n formas, desde que tais escolhas sejam independentes, isto é, nenhuma das escolhas de um elemento pode coincidir com uma escolha do outro.
Regra do Produto: A regra do produto diz que se um elemento H pode ser escolhido de m formas diferentes e se depois de cada uma dessas escolhas, um outro elemento M pode ser escolhido de n formas diferentes, a escolha do par (H,M) nesta ordem poderá ser realizada de m.n formas.
Exemplo: Consideremos duas retas paralelas ou concorrentes sem que os pontos sob análise estejam em ambas, sendo que a primeira r contem m pontos distintos marcados por r1, r2, r3, ..., rm e a segunda s contem n outros pontos distintos marcados por s1, s2, s3, ..., sn. De quantas maneiras podemos traçar segmentos de retas com uma extremidade numa reta e a outra extremidade na outra reta? É fácil ver isto ligando r1 a todos os pontos de s e assim teremos n segmentos, depois ligando r2 a todos os pontos de s e assim teremos n segmentos, e continuamos até o último ponto para obter também n segmentos. Como existem m pontos em r e n pontos em s, teremos m.n segmentos possíveis.
----------------------------------------------------------
Número de combinações simples
Seja C um conjunto com m elementos distintos. No estudo de arranjos, já vimos antes que é possível escolher p elementos de A, mas quando realizamos tais escolhas pode acontecer que duas coleções com p elementos tenham os mesmos elementos em ordens trocadas. Uma situação típica é a escolha de um casal (H,M).
Quando se fala casal, não tem importância a ordem da posição (H,M) ou (M,H), assim não há a necessidade de escolher duas vezes as mesmas pessoas para formar o referido casal. Para evitar a repetição de elementos em grupos com a mesma quantidade p de elementos, introduziremos o conceito de combinação.
Diremos que uma coleção de p elementos de um conjunto C com m elementos é uma combinação de m elementos tomados p a p, se as coleções com p elementos não tem os mesmos elementos que já apareceram em outras coleções com o mesmo número p de elementos.
Aqui temos outra situação particular de arranjo, mas não pode acontecer a repetição do mesmo grupo de elementos em uma ordem diferente.
Isto significa que dentre todos os A(m,p) arranjos com p elementos, existem p! desses arranjos com os mesmos elementos, assim, para obter a combinação de m elementos tomados p a p, deveremos dividir o número A(m,p) por m! para obter apenas o número de arranjos que contem conjuntos distintos, ou seja:
C(m,p) = A(m,p) / p!
Como A(m,p) = m.(m-1).(m-2). ... .(m-p+1), então:
C(m,p) = [ m.(m-1).(m-2). ... .(m-p+1)] / p!
o que pode ser reescrito
C(m,p) = [ m.(m-1).(m-2). ... .(m-p+1)] / [(1.2.3.4....(p-1)p]
Se multiplicarmos numerador e denominador desta fração por
(m-p)(m-p-1)(m-p-2)...3.2.1
que é o mesmo que multiplicar por (m-p)!, o numerador da fração ficará:
m.(m-1).(m-2).....(m-p+1)(m-p)(m-p-1)...3.2.1 = m!
e o denominador ficará:
p! (m-p)!
Assim, a expressão simplificada para a combinação de n elementos tomados p a p, será:
m!
C(m,p) =
---------------------------------------------------------
p! (m-p)!
Número de Arranjos simples
Seja C um conjunto com m elementos. De quantas maneiras diferentes poderemos escolher p elementos (p
c1 c2 c3 c4 c5 ... cm-2 cm-1 cm
Cada vez que um elemento for retirado, indicaremos esta operação com a mudança da cor amarela para a cor bege.
Para escolher o prameiro elemento do conjunto C que possui m elementos, temos m possibilidades. Vamos supor que a escolha tenha caído sobre o m-ésimo elemento de C.
c1 c2 c3 c4 c5 ... cm-2 cm-1 cm
Para escolher o segundo elemento, devemos observar o que sobrou no conjunto e constatamos que agora existem apenas m-1 elementos. Suponhamos que tenha sido retirado o último elemento dentre os que sobraram no conjunto C. O elemento retirado na segunda fase é o (m-1)-ésimo.
c1 c2 c3 c4 c5 ... cm-2 cm-1 cm
Após a segunda retirada, sobraram m-2 possibilidades para a próxima retirada. Do que sobrou, se retirarmos o terceiro elemento como sendo o de ordem (m-2), teremos algo que pode ser visualizado como:
c1 c2 c3 c4 c5 ... cm-2 cm-1 cm
Se continuarmos o processo de retirada, cada vez teremos 1 elemento a menos do que na fase anterior. Para retirar o p-ésimo elemento, restarão m-p+1 possibilidades de escolha.
Para saber o número total de arranjos possíveis de m elementos tomados p a p, basta multiplicar os números que aparecem na segunda coluna da tabela abaixo:
Retirada Número de possibilidades
1 m
2 m-1
3 m-2
... ...
p m-p+1
No.de arranjos m(m-1)(m-2)...(m-p+1)
Denotaremos o número de arranjos de m elementos tomados p a p, por A(m,p) e a expressão para seu cálculo será dada por:
A(m,p) = m(m-1)(m-2)...(m-p+1)
Exemplo: Consideremos as 5 vogais de nosso alfabeto. Quais e quantas são as possibilidades de dispor estas 5 vogais em grupos de 2 elementos diferentes? O conjunto solução é:
{AE,AI,AO,AU,EA,EI,EO,EU,IA,IE,
IO,IU,OA,OE,OI,OU,UA,UE,UI,UO}
e a solução numérica é A(5,2) = 5.4= 20 possibilidades
Exemplo: Consideremos as 5 vogais de nosso alfabeto. Quais e quantas são as possibilidades de dispor estas 5 vogais em grupos de 2 elementos (não necessariamente diferentes)?
Sugestão: Colocar uma reta com as 5 vogais e outra reta paralela à anterior com as 5 vogais, usar a regra do produto para concluir que existem 5x5=25 possibilidades.
O conjunto solução é:
{AA,AE,AI,AO,AU,EA,EE,EI,EO,EU,IA,IE,II,
IO,IU,OA,OE,OI,OO,OU,UA,UE,UI,UO,UU}
Exemplo: Quantas placas de carros podem existir no atual sistema brasileiro de trânsito que permite 3 letras iniciais e 4 algarismos no final?
XYZ-1234
Sugestão: Considere que existem 26 letras em nosso alfabeto que podem ser dispostas 3 a 3 e 10 algarismos que podem ser dispostos 4 a 4 e em seguida utilize a regra do produto.
extraido do colaweb
Nudibrânquios Incríveis lesmas marinhas são animais mais coloridos do mar

Nudibrânquio se alimentando de corais
Os nudibrânquios são pequenos animais marinhos pertencentes ao grupo dos moluscos gastrópodes. São chamados popularmente de lesmas-do-mar. O termo Nudibranchia tem origem grega e significa "brânquias descobertas". O nome faz referência aos órgãos respiratórios externos desses organismos.
Existem cerca de 3.000 espécies de lesmas-do-mar, que ocorrem desde os trópicos até a Antártida. Algumas espécies podem atingir 40 centímetros de comprimento, enquanto outras são microscópicas. A maioria mede, porém, entre 5 e 10 centímetros.
Colorido intenso
As lesmas-do-mar não possuem concha e apresentam simetria bilateral. O manto (parede do corpo dos moluscos) recobre todo o corpo e pode apresentar colorações extremamente vibrantes. As cores intensas conferem aos nudibrânquios o título de criaturas mais coloridas do ambiente marinho e, por essa razão, podemos encontrá-los com freqüência em aquários de água salgada.
A coloração dos nudibrânquios pode ser aposemática, ou seja, uma coloração de aviso aos predadores sobre sua toxicidade ou impalatabilidade, ou então críptica, imitando cores e padrão do meio onde vivem e permitindo que o animal se camufle com perfeição.
Em algumas espécies, o manto apresenta projeções chamadas de cerata (ou, no singular, ceras), no interior das quais existem ramificações do sistema digestivo. A forma e a disposição dessas projeções são características importantes para a identificação da espécie. Como veremos adiante, essas estruturas possuem um importante papel na defesa dos animais.
Respiração
As brânquias, utilizadas na respiração, são externas e dispostas ao longo do corpo ou apenas ao redor do ânus. Algumas espécies não possuem brânquias e respiram através da troca gasosa entre a parede do corpo e a água do mar.
Na parte anterior do corpo existem quimiorreceptores, chamados de rinóforos, capazes de detectar a presença de substâncias químicas na água. Essas estruturas auxiliam na captura de presas e na busca por um parceiro sexual.
Os nudibrânquios possuem um pé musculoso, também chamado de sola, que se estende por todo o comprimento da região ventral. Os movimentos ondulatórios deste pé impulsionam o animal para frente durante a locomoção ou natação.
As lesmas-do-mar possuem uma estrutura denominada rádula, muito comum entre os moluscos, que é utilizada para a alimentação. A rádula é um órgão laminar, situado na cavidade oral, revestido por inúmeros dentículos capazes de raspar e dilacerar o tecido das presas.
Cópula de cinco dias?!
As lesmas-do-mar são hermafroditas, ou seja, o mesmo animal é capaz de produzir tanto óvulos quanto espermatozóides. No entanto, a estrutura de seus órgãos reprodutores impede que ocorra a autofecundação e evita o endocruzamento.
Durante o acasalamento, dois nudibrânquios se posicionam lado a lado e introduzem uma massa, repleta de espermatozóides, no interior de uma abertura reprodutiva situada na região anterior do corpo. Dependendo da espécie, a cópula pode levar apenas alguns segundos ou então se prolongar por horas. Existe até mesmo o registro de um acasalamento que durou cerca de cinco dias!
Os espermatozóides são armazenados no interior do organismo até que os óvulos estejam maduros e a fecundação ocorra. Milhares de ovos são então liberados na água do mar. Uma espécie de muco envolve os ovos, mantendo-os unidos, e permitindo que esta massa ovígera se fixe a um substrato, que, geralmente, é o corpo da presa predileta do adulto.
Após a eclosão dos ovos não há nenhum tipo de cuidado parental e o desenvolvimento dos filhotes pode ser direto, quando do ovo nasce um jovem que é uma miniatura da forma adulta, ou indireto, quando existe um estágio larval, chamado de veliger.
Alimentação
Os nudibrânquios são animais carnívoros que se alimentam de outros invertebrados, como cnidários, esponjas, cracas e ascídeas. Algumas espécies se alimentam dos ovos de outros nudibrânquios e, até mesmo, de indivíduos adultos.
Geralmente, a relação entre estes moluscos e sua presa é muito estreita, e é comum que cada espécie se alimente apenas de alguns tipos específicos de presa.
Defesa
As lesmas-do-mar não possuem concha e por isso seu corpo fica exposto aos predadores. No entanto, estes animais desenvolveram outras formas de defesa. Alguns nudibrânquios são capazes de nadar rapidamente, fugindo do predador; outros secretam ácido sulfúrico e outras substâncias tóxicas.
A forma de defesa mais incrível é, porém, a capacidade de algumas espécies de utilizar as estruturas urticantes dos cnidários (nematocistos) em sua própria defesa. Esses animais ingerem tecidos de cnidários, sem disparar os nematocistos, que são então transportados através do sistema digestivo até a extremidade das cerata.
Quando um predador tenta capturar o nudibrânquio, os nematocistos disparam, provocando queimaduras e lesões no agressor. Muitas vezes, a coloração do animal serve como aviso ao predador sobre sua toxicidade, repelindo-o antes mesmo do ataque.
Alice Dantas Brites
Reações químicas Análise de evidências

Colégio Estadual Dinah Gonçalves
email
accbarroso@hotmail.com
As reações químicas, processos que caracterizam as transformações químicas, são fenômenos que ocorrem aos milhares em diversas situações e condições ao nosso redor. Às vezes percebemos algumas delas, mas muitas vezes não as notamos.
Por exemplo, a formação de ferrugem em um portão de ferro exposto à ação do ar é uma dessas reações que percebemos. É comum os químicos representarem as reações químicas por meio de equações químicas. No caso da ferrugem pode-se representá-la assim:

Nesta equação verifica-se a combinação química do ferro (Fe) com o oxigênio (O2) e água (H2O), formando óxido de ferro, ou ferrugem (Fe2O3.H2O), material que é facilmente verificado pelos sinais apresentados no processo, ou seja, as evidências de uma transformação química. No caso em questão, há formação de uma substância marrom insolúvel em água.
Contudo, é necessário certo cuidado ao analisar as evidências, pois nem sempre elas caracterizam uma transformação química. Os processos de dissolução (soluto sendo dissolvido por um solvente), por exemplo, em geral não são classificados como transformações químicas, pois esses processos caracterizam-se, a rigor, por serem transformações físicas.
Como verificar se ocorreu transformação química?
As evidências de que uma transformação química ocorreu são, em geral: a liberação de gases e/ou luz, a mudança de cor ou temperatura e a formação de precipitado (formação de um sólido insolúvel após interação de dois reagentes solúveis). Podem-se verificar essas evidências por meio de alguns testes simples com materiais comuns, encontrados nos laboratórios escolares. Porém, é importante frisar que tais testes requerem orientação do professor de química, principalmente por questões de segurança.
A adição de alguns mililitros de uma solução de iodeto de potássio (KI) a outra de nitrato de chumbo [Pb(NO3)2], permite a identificação de uma transformação química por meio da formação de um precipitado (ppt). Um ppt amarelo intenso de iodeto de chumbo (PbI2) de fácil visualização. A equação química dessa transformação pode ser assim representada:

Outras reações químicas são identificadas pela liberação de gás, de calor e de luz. Esses sinais característicos são facilmente percebidos na combustão de enxofre. Aquecendo uma pequena quantidade de enxofre (pó amarelo), em ambiente adequado, há a combustão do material, transformando-o no gás dióxido de enxofre, gás formador de chuva ácida. Veja a equação da combustão:

Esta é uma reação de síntese em que o enxofre aquecido reagiu com o oxigênio do ar, produzindo dióxido de enxofre (gás), luz e calor.
Outra transformação química que apresenta como evidências calor, certa luminosidade e gás é a reação entre ácido clorídrico e o metal magnésio. (Lembramos, mais uma vez, a importância da orientação do professor com estes testes por questões de segurança, uma vez que essa reação, além do manuseio de ácido, que já representa certo perigo, produz gás hidrogênio, que é facilmente inflamável.)
Em um tubo de ensaio com solução diluída de ácido clorídrico, adiciona-se um pedaço de magnésio. Na reação, o magnésio se decompõe, liberando gás (hidrogênio), que rapidamente passa para o ambiente. O aquecimento do líquido no tubo de ensaio é facilmente perceptível. O magnésio reage com o ácido clorídrico (equação abaixo), produzindo cloreto de magnésio (MgCl2) e o gás hidrogênio (H2), que escapa para fora do tubo:

Uma transformação química que pode ser verificada por mudança de cor dos materiais acontece na reação do metal ferro, quando mantido por algum tempo em um béquer contendo uma solução aquosa de sulfato de cobre II (CuSO4). Neste caso, há a mudança de cor na solução aquosa de sulfato de cobre II, de azul para verde.
A mudança de cor na solução aquosa se deve ao fato de que o elemento ferro presente na barra reage com o cobre presente na solução aquosa de sulfato de cobre II. O produto formado é a solução de sulfato de ferro II (FeSO4), que possui a cor meio esverdeada. O cobre na forma metálica pode ser visto depositado sobre a barra de ferro. Esse fenômeno é representado pela equação:

A equação apresenta a seqüência química: Fe(metal) + CuSO4 (solução aquosa de sulfato de cobre II) ==> Cu (metal) + FeSO4 (solução aquosa de sulfato de ferro II).
Como já foi salientado, as evidências não determinam uma transformação química, porém ajudam a identificar os sinais de quando ocorrem ou não as reações químicas. Assim, um estudo sobre esses aspectos permite a compreensão de fatores relacionados às reações químicas, com o objetivo de entender e controlar boa parte das transformações químicas que acontecem ao nosso redor.
Bibliografia
# ATKINS, P. W.; JONES, L. L. Princípios de Química: questionando a vida moderna e o meio ambiente. Porto Alegre, Bookman, 2001.
# GEPEQ. Interações e transformações I: elaborando conceitos sobre transformações químicas. Química - Ensino Médio. Livro do aluno e guia do professor. São Paulo, USP, 2001.
# LEMBO A. Química: realidade e contexto. São Paulo, Editora Ática, 2001.
As relações ecológicas
Colégio Estadual Dinah Gonçalves
email
accbarroso@hotmail.com
As relações ecológicas entre seres vivos podem ser representadas graficamente por meio da construção das chamadas pirâmides ecológicas. Essas pirâmides representam as variações de massa, número e energia dentro de um ecossistema.
Pirâmide de energia
Expressa a quantidade de energia acumulada em cada nível da cadeia alimentar. Como a energia apresenta um fluxo decrescente, quanto mais distante dos produtores, menor será a quantidade de energia útil recebida.
Pirâmide de biomassa
Expressa a quantidade de biomassa, matéria viva acumulada em cada nível trófico da cadeia alimentar. É representada pelo peso seco consumido numa cadeia alimentar e expressa a quantidade de matéria orgânica por área. É direta nos ecossistemas terrestres que têm produtores com biomassa muito maior que os consumidores. Porém é invertida em ecossistemas aquáticos onde os produtores são bem menores e consumidos em grande quantidade por consumidores cada vez maiores. Este tipo de ecossistema só pode existir devido ao alto grau de reprodução que é feito pelos produtores representados ali, geralmente o fitoplâncton.
Demonstra o número de indivíduos que existe em cada nível trófico. Dependendo do tipo de ecossistema, a pirâmide de números pode ser direta ou invertida. Podemos ter três tipos básicos de cadeias alimentares: a) de predadores que promoverá pirâmides diretas; b) de parasitas e superparasitas que dará pirâmides invertidas; c) de detritívoros que dará pirâmides diretas.
No caso de parasitos e superparasitos, assim como no caso de pragas, temos pirâmides invertidas.
A palavra "ecologia" designa o estudo da "casa" (oikos (grego) = eco = casa). Assim, a ecologia leva em consideração a interação entre os seres vivos e o meio ambiente e as interações entre os seres vivos, uns com os outros.
Podemos considerar os seguintes níveis hierárquicos de organização:
1- lei da segregação: carregam o código das características dos seres vivos;
2- células: são consideradas a unidade da vida; é dentro dela que se econtram os genes;
3- tecidos: formados pela união de células que funcionam em conjunto;
4- órgãos: a interação de alguns tecidos para um determinado fim específico;
5- indivíduos: formados pela sistematização dos órgãos; quando parecidos pertencem a uma mesma espécie;
6- população: conjunto de indivíduos;
7- comunidades: conjunto de populações interagindo entre si e com o meio ambiente;
8- ecossistemas: conjunto de diversas comunidades;
9 - biosfera: os vários ecossistemas do planeta.
A Ecologia preocupa-se principalmente com os seguintes níveis conceituados abaixo:
Espécie – Este conceito ainda permanece muito controverso, mas, de maneira simplificada, podemos entender espécie como um conjunto de indivíduos que possuem semelhanças morfo-fisiológicas extrapolando-se estas para o nível molecular e que podem gerar indivíduos férteis.
Os Ecossistemas
Início » Biologia » Cadeia Alimentar » Os Ecossistemas
Assim como uma célula pode ser considerada a unidade fundamental da vida, os ecossistemas podem ser considerados a unidade fundamental de estudo da ecologia. Eles são formados pela união de dois fatores:
Fatores abióticos – Conjunto de todos os fatores ambientais que atuam diretamente no mundo vivo. Os indivíduos euribiontes são capazes de tolerar amplos limites de variações das condições do meio onde vivem. Já os estenobiontes, apresentam limites de tolerância baixos. Alguns destes fatores são: temperatura, luz e água.
Fatores bióticos – Conjunto de todos os seres vivos que interagem em uma certa região. Podem ser chamados de biocenose, comunidade ou biota.
Exemplo: chamava-se de microflora, flora autóctone ou ainda flora normal todo o conjunto de a importância das bactérias e seres, os corpos que viviam no interior do corpo humano ou sobre a pele. Hoje, o termo mais adequados, aos termos ecológicos seria microbiota normal.
População – Conjunto de indivíduos pertencentes a uma mesma espécie e que habitam uma mesma localidade geográfica.
Comunidade - Conjunto de todas as populações que vivem em um mesmo ambiente (biocenose). Sobre uma comunidade haverá incidência dos diversos fatores físicos existentes nela.
Ecossistema – Relação existente entre uma comunidade e todos os fatores físicos que sobre ele incidirem. Existem vários ecossistemas no mundo. Pode-se considerar a palavra ecossistema equivalente à palavra BIOMA. Existem na natureza vários biomas, como, por exemplo, as florestas tropicais, os oceanos, a mata atlântica, a caatinga, os cerrados, os desertos, etc.
Biosfera: Conjunto de todos os ecossistemas existentes no planeta.
www.colegioweb.com.br
Santa Catarina

Bandeira de Santa Catarina
Significado da bandeira: o losango verde representa a vegetação; a águia, a força produtiva de Santa Catarina; o trigo e o café, as lavouras das serras e do litoral; e a chave, a posição estratégica do estado no território brasileiro.
O estado de Santa Catarina, juntamente com Rio Grande do Sul e Paraná, integra a Região Sul do Brasil. Seu território, banhado pelo oceano Atlântico na porção leste, possui fronteiras ao norte com o Rio Grande do Sul, ao sul com o Paraná e a oeste com a Argentina.
Santa Catarina, com extensão territorial de 95.703,487 quilômetros quadrados, é o menor estado sulista. Sua área está fragmentada em 293 municípios, cuja capital é a cidade de Florianópolis. De acordo com dados divulgados em 2010 pelo Instituto Brasileiro de Geografia e Estatística (IBGE), o estado possui 6.249.682 habitantes, sendo a densidade demográfica de 65,3 habitantes por quilômetro quadrado.
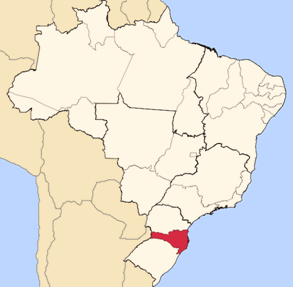
Santa Catarina no mapa do Brasil
Situada na Zona Temperada do Sul, Santa Catarina possui clima subtropical. A vegetação é diversificada, apresentando mangues litorâneos, mata de araucária, campos e floresta. O relevo é marcado por terrenos baixos, enseadas, planaltos e depressão. A rede hidrográfica é composta pelos rios Canoas, do Peixe, Itajaí-Açu, Pelotas, Peperi-Guaçu, Negro e Uruguai.
A economia estadual é diversificada e apresenta força nos três seguimentos que compõem o Produto Interno Bruto (PIB): serviços, indústria e agropecuária. Santa Catarina é grande produtora de milho, arroz, banana, maçã, soja, cana-de-açúcar e mandioca. As principais indústrias são as têxteis, cerâmica, metalúrgicas e alimentícias. O turismo é o grande responsável pela ascensão do setor de serviços. Florianópolis, Balneário Camboriú e Garopaba recebem milhares de visitantes anualmente.
Os catarinenses desfrutam de elevado padrão socioeconômico. Santa Catarina detém o segundo melhor Índice de Desenvolvimento Humano (IDH) do Brasil, atrás somente do Distrito Federal. Entre os fatores que contribuem para essa posição privilegiada estão: a taxa de mortalidade infantil é de apenas 15 para cada mil nascidos vivos; o índice de analfabetismo é de 4%; o PIB per capita é de aproximadamente 18 mil reais.
alunosonline.com.br
Famoso Diálogo de Gandhi com Seu Professor Arrogante
 |
| Mahatma Gandhi |
Através de muitas pesquisas na rede internet, soubemos que Mahatma Gandhi (1869-1948), nascido na Índia Britânica, quando estudava Direito numa instituição chamada: College London na cidade de Londres, Inglaterra, ele tinha um professor chamado: “Peters” que julgava não gostar dele, mas Gandhi nunca baixou a sua cabeça, e eram vários os seus contatos e reencontros, os quais muitas vezes eram tensos e até por vezes depressivos.
Um dia, o seu professor estava se alimentando no refeitório da universidade e casualmente Gandhi (aluno na época), sentou-se à mesma mesa com ele. Então, o mestre como não teria ficado satisfeito com a coincidência do encontro e talvez querendo até menosprezá-lo, apresentou a seguinte indagação:
O professor disse-lhe em tom de deboche:
Senhor Gandhi, você não sabe que um porco e um pássaro nunca comem juntos? - Ok. querido Professor, já vou voando… - E, mudou-se de mesa no mesmo instante ....
Senhor Gandhi, você não sabe que um porco e um pássaro nunca comem juntos? - Ok. querido Professor, já vou voando… - E, mudou-se de mesa no mesmo instante ....
O professor ficou aborrecido com o ocorrido, e resolveu vingar-se no exame seguinte, mas o aluno Gandhi respondeu brilhantemente a todas as perguntas formuladas, pois como sabemos, ele era um excelente estudante de direito. Então, o professor Peters resolveu fazer mais uma pergunta: Senhor Gandhi, meu querido e brilhante aluno, vou fazer-lhe outra pergunta: - Caso você estivesse transitando por uma rua e o senhor encontrasse uma bolsa, e abrindo-a, encontrasse duas coisas: a sabedoria e muito dinheiro .... - Se pudesse escolher entre eles, com qual ficaria?
- Claro que ficaria com o dinheiro! ... professor! ...
- Ah!... pois, eu no seu lugar ficaria com a sabedoria!…
- Tem razão professor, cada um fica com o que não tem!...
- Claro que ficaria com o dinheiro! ... professor! ...
- Ah!... pois, eu no seu lugar ficaria com a sabedoria!…
- Tem razão professor, cada um fica com o que não tem!...
O professor furioso com tudo isso e disposto a se vingar, quando foi corrigir uma de suas avaliações de rotina, escreveu na sua prova “idiota” e entregou-a. - Gandhi recebeu a prova e sentou-se, e em alguns minutos depois, foi ter com o professor e disse-lhe:
- Professor! ... O Senhor assinou a prova, mas não pôs a nota…
- Professor! ... O Senhor assinou a prova, mas não pôs a nota…
Conclusão
Nesta história, vemos que a postura do grande líder e também grande pensador Mahatma Gandhi, embora na ocasião fosse um simples aluno, ele já tinha uma inteligência acima da média de seus pares e provavelmente também estaria a frente de seu professor. Esse relato, no qual ele venceu com as suas atitudes o seu mestre, realmente aconteceu naquela escola da Inglaterra. O que fica aqui enfatizado nesse diálogo é que essa relação professor-aluno sempre foi e ainda continua sendo tensa para ambos os lados, tendo em vista que alguns professores ou mestres, se colocam como onipotentes, ou seja, aqueles que sabem tudo e que sempre tem razão em todos os sentidos, e muitas vezes acham que os seus alunos nunca sabem nada, mas isso, sabemos que muitas vezes não é verídico, como ocorreu no caso exposto. Hoje, essa relação já vem sendo muito discutida e até retificada, e o bom professor, sempre aprende com os seus alunos. Ele é sempre o mediador e o facilitador para o aprendizado de seus discentes. Criar um clima agradável, de respeito e cooperação entre todos deve ser o norteador de todo mestre que preza pelo ensino de qualidade, pois, acreditamos que isso facilitará muito o aprendizado de todos. Acreditamos que o aluno Gandhi daquela conceituada escola, com toda a sua capacidade e inteligência, possa ter causado um desconforto para com seu professor, que sentiu-se inseguro com as suas atitudes, que de certo modo confrontaram como o modo de agir e pensar do seu mestre. Talvez nesse episódio, o professor pudesse estabelecer uma relação cordial e respeitosa com o seu aluno e provavelmente ele poderia até ajudá-lo no aprendizado e relacionamento com os demais alunos que frequentavam aquela famosa escola naquela ocasião.
fonte:recordandomatematica.blogspot.com.br
Etnia Brasileira
Etnia Brasileira
Por Alunos Online
Brasil: um país com grande diversidade étnica
Etnia são grupos de pessoas que são definidas pelas suas origens e por seus traços físicos e culturais. Este termo é usado para substituir o termo raça que era usado de forma abusiva já que não existem raças de seres humanos e sim pessoas de características diferentes.
No Brasil existe uma diversidade de etnias já que as origens provêm da fusão de diferentes grupos étnicos.
Existem grupos classificados em:
Mulatos: São descendentes de negros e brancos.
Caboclos: São descendentes de índios e brancos.
Cafuzo: São descendentes de índios e negros.
Indígenas: São nativos da região brasileira.
Brancos: São os que apresentam pouca pigmentação, ou seja, pele clara.
Negros: São os que apresentam grande pigmentação, ou seja, pele escura.
Caboclos: São descendentes de índios e brancos.
Cafuzo: São descendentes de índios e negros.
Indígenas: São nativos da região brasileira.
Brancos: São os que apresentam pouca pigmentação, ou seja, pele clara.
Negros: São os que apresentam grande pigmentação, ou seja, pele escura.
Existem fatos curiosos acerca da etnia de uma pessoa, pois existem brancos que possuem descendência negra que é apresentada em determinada parte do corpo ou as vezes que nem possui característica nenhuma, mas reconhece seus antepassados.
sexta-feira, 25 de outubro de 2019
Acento é Grave, O

O uso do sinal indicativo de crase é um suplício
A crase é uma desgraça! Abaixo a crase! Serve pra quê? Ouvimos sempre essas reclamações dos alunos, porque ela incomoda mais que o elefante daquela musiquinha. Uma crase incomoda muita gente, duas crases...
Crase não é acento, é convenção, logo não marca a tonicidade. Os usuários (não do transporte coletivo, mas da língua) enfiam o acento grave conforme a eufonia. É forte, vai crase. Doce e grave engano.
O inusitado acontece por obra e graça de uma língua na qual a preposição e o artigo são idênticos: a. Daí à tragédia (com crase) é um passo. Os castelhanos perceberam o caos e se anteciparam: o artigo é la; e a preposição, a. Assim: Vamos a la casa de Maria é um enunciado claro, limpo, como a casa da própria.
Na outra ibérica língua, a de Fernando Pessoa, teríamos: Vamos aa casa de Maria. Quem daria crédito a esta grafia aa? Diriam tratar-se de coisa tipicamente lusitana. Bobagem reservada às (com crase) piadas.
De qualquer modo, experimente, heróico leitor dessa coluna, a pronúncia desses dois aas. Que tal? Não sentiu, por acaso, um bloqueio pulmonar? Logo, frisemos que o uso da crase é, antes de tudo, uma questão de saúde pública. Salvam-se os pulmões graças à (com crase) balsâmica crase.
Artifícios surgem como forma de evitar essa epidemia tão grave e aguda quanto a do Ebola. Troca-se a palavra à qual (com crase) a crase está ligada por uma masculina, surgindo ao, vai crase. Exemplo: Vai à praia. Vai ao litoral.
Adiante. Se a crase é a contração de a+a, ela poderá acontecer na frente de palavras femininas. Em Compro a crediário ou Compro a prazo temos o a como simples e inofensiva preposição, pois o artigo de prazo e de crediário é o. Pô!
Porém nada pode ser tão simples na vida do falante distraído da língua mãe de Bilac (cuidado! não disse falante da língua da mãe distraída do Bilac). Surgem, de inopino, não se sabe de onde, as locuções adverbiais femininas. Aqui não adiantam artifícios de troca por ao. Exemplos: Dobrar à direita; Ricardão colocou as calças às pressas; Saiu às cegas catando o Ricardão; A mulher estava às apalpadelas com o Ricardão; Agarrou a colega à unha; Estava à toa na vida, quando o Ricardão chegou às escondidas. Entretanto - Trancou a mulher a cadeado; Andava com ela a tiracolo. Todo o cuidado é pouco (com a crase e com o Ricardão).
Viu só, matei à paulada, mas matei a pau. Uau!
www.algosobre.com.br
Barroco

O tempo barroco denomina genericamente todas as manifestações artísticas dos anos 1600 e início dos anos 1700. Além da literatura, estende-se à música, pintura, escultura e arquitetura da época.
Mesmo considerando o Barroco o primeiro estilo de época da literatura brasileira e Gregório de Matos o primeiro poeta efetivamente brasileiro, com sentimento nativista manifesto, na realidade ainda não se pode isolar a Colônia da Metrópole. Ou, como afirma Alfredo Bosi: "No Brasil houve ecos do Barroco europeu durante os séculos XVII e XVIII: Gregório de Matos, Botelho de Oliveira, Frei Itaparica e as primeiras academias repetiram motivos e formas do barroquismo ibérico e italiano". Além disso, os dois principais autores Pe. Antônio Vieira e Gregório de Matos tiveram suas vidas divididas entre Portugal e Brasil. Por essas razões, neste capítulo não separaremos as manifestações barrocas de Portugal e do Brasil.
Em Portugal, o Barroco ou Seiscentismo tem seu início em 1580 com a unificação da Península Ibérica, o que acarretará um forte domínio espanhol em todas as atividades, daí o nome Escola Espanhola, também dado ao Barroco lusitano. O Seiscentismo se estenderá até 1756, com a fundação da Arcádia Lusitana, já em pleno governo do Marquês de Pombal, aberto aos novos ares da ideologia liberal burguesa iluminista, que caracterizará a segunda metade do século XVIII.
No Brasil, o Barroco tem seu marco inicial em 1601 com a publicação do poema épico Prosopopéia, de Bento Teixeira, que introduz definitivamente o modelo da poesia camoniana em nossa literatura. Estende-se por todo o século XVII e início do século XVIII. O final do Barroco brasileiro só se concretizou em 1768, com a fundação da Arcádia Ultramarina e com a publicação do livro Obras, de Cláudio Manuel da Costa. No entanto, já a partir de 1724, com a fundação da Academia Brasílica dos Esquecidos, o movimento academicista ganhava corpo, assinalando a decadência dos valores defendidos pelo Barroso e a ascensão do movimento árcade.
Momento histórico
Se o início do século XVI, notadamente seus primeiros 25 anos, pode ser considerado o período áureo de Portugal, não é menos verdade que os 25 últimos anos desse mesmo século podem ser considerados o período mais negro de sua história.
O comércio e a expansão do império ultramarino levaram Portugal a conhecer uma grandeza aparente. Ao mesmo tempo que Lisboa era considerada a capital mundial da pimenta, a agricultura lusa era abandonada. As colônias, principalmente o Brasil, não deram a Portugal riquezas imediatas; com a decadência do comércio das especiarias orientais observa-se o declínio da economia portuguesa. Paralelamente, Portugal vive uma crise dinástica: em 1578, levando adiante o sonho megalomaníaco de transformar Portugal novamente num grande império, D. Sebastião desaparece em Alcácer-Quibir, na África; dois anos depois, Filipe II da Espanha consolida a unificação da Península Ibérica tal situação permaneceria até 1640, quando ocorre a Restauração (Portugal recupera sua autonomia).
A perda da autonomia e o desaparecimento de D. Sebastião originam em Portugal o mito do Sebastianismo (crença segundo a qual D. Sebastião voltaria e transformaria Portugal no Quinto Império). O mais ilustre sebastianista foi sem dúvida o Pe. Antônio Vieira, que aproveitou a crença surgida nas "trovas" de um sapateiro chamado Gonçalo Anes Bandarra.
A unificação da Península veio favorecer a luta conduzida pela Companhia de Jesus em nome da Contra-Reforma: o ensino passa a ser quase um monopólio dos jesuítas e a censura eclesiástica torna-se um obstáculo a qualquer avanço no campo científico-cultural. Enquanto a Europa conhecia um período de efervescência no campo científico, com as pesquisas e descobertas de Francis Bacon, Galileu, Kepler e Newton, a Península Ibérica era um reduto da cultura medieval.
Com o Concílio de Trento (1545-1563), o Cristianismo se divide. De um lado os estados protestantes (seguidores de Lutero introdutor da Reforma) que propagavam o "espírito científico", o racionalismo clássico, a liberdade de expressão e pensamento. De outro, os redutos católicos (a Contra-Reforma) que seguiam uma mentalidade mais estreita, marcada pela Inquisição (na verdade uma espécie de censura) e pelo teocentrismo medieval.
É nesse clima que se desenvolve a estética barroca, notadamente nos anos que se seguem ao domínio espanhol, já que a Espanha é o principal foco irradiador do novo estilo.
O quadro brasileiro se completa, no século XVII, com a presença cada vez mais forte dos comerciantes, com as transformações ocorridas no Nordeste em conseqüência das invasões holandesas e, finalmente, com o apogeu e a decadência da cana-de-açúcar.
Caratcterísticas
O estilo barroco nasceu da crise de valores renascentistas ocasionada pelas lutas religiosas e pela crise econômica vivida em conseqüência da falência do comércio com o Oriente. O homem do Seiscentismo vivia um estado de tensão e desequilíbrio, do qual tentou evadir-se pelo culto exagerado da forma, sobrecarregando a poesia de figuras, como a metáfora, a antítese, a hipérbole e a alegoria.
Todo o rebuscamento que aflora na arte barroca é reflexo do dilema, do conflito entre o terreno e o celestial, o homem e Deus (antropocentrismo e teocentrismo), o pecado e o perdão, a religiosidade medieval e o paganismo renascentista, o material e o espiritual, que tanto atormenta o homem do século XVII. A arte assume, assim, uma tendência sensualista, caracterizada pela busca do detalhe num exagerado rebuscamento formal.
Podemos notar dois estilos no barroco literário: o Cultismo e o Conceptismo.
* Cultismo: é caracterizado pela linguagem rebuscada, culta, extravagante (hipérboles), descritiva; pela valorização do pormenor mediante jogos de palavras (ludismo verbal), com visível influência do poeta espanhol Luís de Gôngora; daí o estilo ser também conhecido por Gongorismo. No cultismo valoriza-se o "como dizer".
* Conceptismo: é marcado pelo jogo de idéias, de conceitos, seguindo um raciocínio lógico, racionalista, que utiliza uma retórica aprimorada (arte de bem falar, ou escrever, com o propósito de convencer; oratória). Um dos principais cultores do Conceptismo foi o espanhol Quevedo, de onde deriva o termo Quevedismo. Valoriza-se, neste estilo, "o que dizer".
Na literatura, as características principais são:
* Culto do contraste: o poeta barroco se sente dividido, confuso. A obra é marcada pelo dualismo: carne X espírito, vida X morte, luz X sombra, racional X místico. Por isso, o emprego de antíteses.
* Pessimismo: devido a tensão (dualidade), o poeta barroco não tinha nenhuma perspectiva diante da vida.
* Literatura moralista: a literatura tornou-se um importante instrumento para educar e para "pregar" por parte dos religiosos (padres).
Fonte: Olhar Literário http://www.olharliterario.hpg.ig.com.br/barroco.htm
Assinar:
Comentários (Atom)