Ligações Químicas
Ligação iônica
Uma substância muito usada pelo ser humano é o cloreto de sódio (principal componente do sal de cozinha), substância composta pelos elementos sódio e cloro.
Consultando a tabela periódica, temos:
| Elemento | nº de prótons | nº de elementos | Carga elétrica total |
|---|---|---|---|
Sódio (Na)
|
11
|
11
|
0
|
Cloro (Cl)
|
17
|
17
|
0
|
Agora compare a eletrosfera desses elementos com a dos gases nobres:
| Elemento | nº de prótons | nº de elementos | Carga elétrica total |
|---|---|---|---|
Hélio (He)
|
2
|
2
|
0
|
Neônio (Ne)
|
10
|
10
|
0
|
Argônio (Ar)
|
18
|
18
|
0
|
Criptônio (Kr)
|
36
|
36
|
0
|
Xenônio (Xe)
|
54
|
54
|
0
|
Radônio (Rn)
|
86
|
86
|
0
|
Você notou que a eletrosfera do sódio está mais próxima, em número de elétrons, da eletrosfera do neônio? E que a do cloro está mais próxima da do argônio?
Se o sódio perder um elétron, sua eletrosfera passará a ter o mesmo número de elétrons no neônio. E se o cloro receber um elétron ficará com o mesmo número de elétrons do argônio.
Os cientistas concluíram que, no cloreto de sódio, os átomos de sódio têm 10 elétrons e os de cloro têm 18. Como conseqüência esses átomos não são eletricamente neutros.
| Elemento | nº de prótons | nº de elementos | Carga elétrica total |
|---|---|---|---|
Sódio (Na)
|
11
|
10
|
+ 1
|
Cloro (Cl)
|
17
|
18
|
- 1
|
Quando átomos perdem ou recebem elétrons eles deixam de ser eletricamente nêutrons e passam a ser íons.
O íon de sódio representado pó Na+, o que indica a sua carga positiva. O íon de cloro é representado por Cl-, o que indica a sua carga negativa.
Como os íons Na+ e Cl- possuem cargas de sinais opostos, atraem-se mutuamente e mantêm-se unidos. Essa união entre íons é chamada de ligação iônica, e origina uma estrutura altamente organizada, o retículo cristalino iônico, esquematizado no desenho ao lado.
| 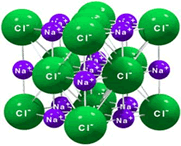 |
|---|
Ligação covalente
A ligação iônica permite explicar como se unem átomos de um elemento que perde elétrons para se assemelhar a um gás nobre e de outro elemento, que recebe elétrons para se assemelhar a um gás nobre.
Mas como explicar a união entre átomos de um ou mais elementos químicos que precisam receber elétrons?
Vamos examinar os casos das substâncias H2, O2, N2, Cl2 e H2O. Procurando esses elementos na tabela periódica temos: | Elemento | nº de prótons | nº de elementos | Carga elétrica total |
|---|---|---|---|
Hidrogênio (H)
|
1
|
1
|
0
|
Nitrogênio (N)
|
7
|
7
|
0
|
Oxigênio (O)
|
8
|
8
|
0
|
Cloro (Cl)
|
17
|
17
|
0
|
Compare o número de elétrons desses átomos com o dos gases nobres mostrados na tabela da pagina anterior.
Para se assemelhar ao hélio, o hidrogênio precisa de mais 1 elétron. Para se assemelhar ao neônio, o nitrogênio necessita de 3 elétrons e o oxigênio, de 2. E o cloro precisa de 1 elétron para ficar com o mesmo número de elétrons do gás nobre argônio.
Os químicos propuseram que, em substâncias como H2, O2, N2, Cl2 e H2O, os átomos se mantêm unidos porque suas elétrosferas compartilham alguns elétrons – a quantidade suficiente para que eles passem a ter eletrosfera semelhante à de gás nobre. Nas representações seguintes, as bolinhas pretas representam os elétrons compartilhados pelos átomos ao formar essas substâncias.
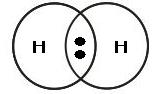 | 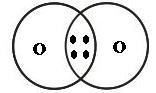 | 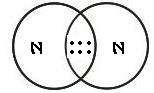 |
Nenhum dos átomos envolvidos transformou-se em íon, ou seja, nenhum deles perdeu ou recebeu elétrons.
Devido ao compartilhamento, todos passaram a ter, em suas eletrosferas, a quantidade de elétrons que os faz se assemelharem a gases nobres.
Quando átomos se unem por compartilhamento de elétrons, dizemos que entre eles se estabelece uma ligação covalente. Os grupos de átomos unidos por ligação covalente são chamados moléculas.
Ligação metálica
Tomamos contato diário com muitas substâncias formadas apenas por átomos de metais, chamadas substâncias metálicas. Entre os exemplos mais conhecidos estão o ferro, o alumínio, o chumbo, o cobre e a prata.
Como os átomos se unem para formar essas substâncias?
Vamos olhar para o modelo do átomo abaixo. Os elétrons, dotados de carga negativa, são atraídos pelo núcleo, no qual, além dos nêutrons, estão os prótons, que apresentam carga positiva. A atração que o núcleo, carregado positivamente, exerce sobre os elétrons é responsável pelo fato de esses elétrons permanecerem no átomo, em vez de o abandonarem.
Uma idéia semelhante a essa pode ser usada para imaginar a ligação entre átomos de metais, denominada ligação metálica.
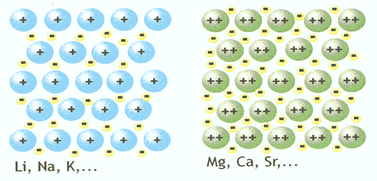
Consideremos uma amostra da substância simples prata. Ela é formada por um aglomerado de muitos átomos de elemento químico prata. Nesse aglomerado, cada átomo está rodeado por outros átomos iguais a ele. O núcleo de cada átomo exerce atração sobre os elétrons de sua eletrosfera e também sobre os elétrons dos átomos vizinhos, mantendo toda a estrutura unida.
Os elétrons, por sua vez, não estão totalmente presos a um átomo apenas, podendo “transitar” por toda a estrutura. Alguns cientistas usam a expressão “mar de elétrons” para designar essa situação.
As substâncias metálicas (ou, simplesmente, metais) são úteis ao ser humano devido às suas propriedades, que, de modo bem genérico, são as listadas a seguir.
- Brilho característico. Quando polidos, os metais refletem muito bem a luz. Essa propriedade é fácil de ver em bandejas e espelho de prata.
- Alta condutividade térmica e elétrica. São propriedades que se devem aos elétrons livres. O movimento ordenado dos elétrons constitui a corrente elétrica e sua agitação permite a rápida programação do calor através das substâncias metálicas.
- Altos pontos de fusão e ebulição. Em geral são características dos metais (embora, haja exceções, como mercúrio, PF = -39ºC; gálio, PF = 30ºC, e potássio, PF = 63ºC). Devido a essa propriedade e também à boa condutividade térmica, alguns metais são usados em panelas e em radiadores de automóveis.
- Maleabilidade. Metais são muito maleáveis, ou seja, fáceis de serem transformados em lâminas. O metal mais maleável é o ouro, que permite a obtenção das lâminas mais finas.
- Ductibilidade. Metais também são muito dúcteis, isto é, fáceis de serem transformados em fios. O ouro é também o mais dúctil dos metais, permitindo que dele se obtenham fios finíssimos.
Nenhum comentário:
Postar um comentário