Colégio Estadual Dinah Gonçalves
email accbarroso@hotmail.com
www.accbarrosogestar.wordpress.comA matéria e suas propriedades
A Química é a ciência que estuda a constituição da matéria, sua estrutura interna, as relações entre os diversos tipos de materiais encontrados na natureza, além de determinar suas propriedades, sejam elas físicas – como, por exemplo, cor, ponto de fusão, densidade, etc. – ou químicas, que são as transformações de uma substância em outra.
Matéria, Corpo e Objeto
Chamamos matéria a tudo que tem massa, ocupa lugar no espaço e pode, portanto, de alguma forma, ser medido. Por exemplo: madeira, alumínio, ferro, ar, etc.
Corpo é uma porção limitada da matéria e objeto é um corpo fabricado para um determinado fim.

O bloco de parafina é um corpo
| 
A vela é um objeto
|
Resumindo, podemos dizer que o ferro é matéria, uma barra de ferro é um corpo e um portão de ferro é um objeto.
Propriedades da Matéria
A matéria apresenta várias propriedades que são classificadas em gerais, funcionais e específicas.
Propriedades Gerais da Matéria
São comuns a toda e qualquer espécie de matéria, independentemente da substância de que ela é feita. As principais são: massa, extensão, impenetrabilidade, divisibilidade, compressibilidade e elasticidade.
Massa
A massa é uma propriedade dos corpos relacionada à quantidade de matéria que o corpo possui.
Ela é uma grandeza que pode ser medida. A medida padrão utilizada para medir a massa é o quilograma (kg), segundo o sistema internacional de Unidades (SI). O grama (g) é uma unidade de massa derivada do quilograma, e é empregado na medida de pequenas quantidades de massa.
A balança é o instrumento utilizado para medir a massa.
 Balança de pratos Balança de pratos | 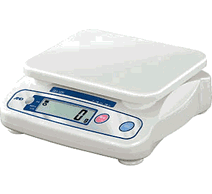
Balança eletrônica
|
Volume
O volume é uma grandeza que indica o espaço ocupado por uma determinada quantidade de matéria.
No sistema internacional (SI), a unidade que mede o volume é o metro cúbico (m3). Também é comum a utilização do litro ou do mililitro (mL) na medida de volume. O leite, o refrigerante e muitos outros líquidos podem ser medidos usando-se o litro como unidade de medida.
O decímetro cúbico e o litro
O decímetro cúbico (dm3) é o volume de um cubo cuja aresta meça 1 dm (um decímetro), ou seja, 10 cm. Essa unidade é equivalente ao litro (L)
1 dm3 = 1L
O centímetro cúbico e o mililitro
O centímetro cúbico (cm3) é o volume de um cubo cuja aresta meça 1 cm. Agora acompanhe o raciocínio: Um decímetro cúbico corresponde a mil centímetros cúbicos (1 dm3) = (1000 cm3). O mililitro (mL) é a milésima parte do litro e, assim, um litro corresponde a mil mililitros (1L = 1000 mL).
Como um décimo cúbico equivale a um litro, podemos, então afirmar que:
1 dm3 = 1L = 1.000 cm3 = 1000 ml
Assim, decorre que: 1cm3 = 1 ml
Extensão: Propriedade que a matéria tem de ocupar um lugar no espaço. O volume mede a extensão de um corpo.
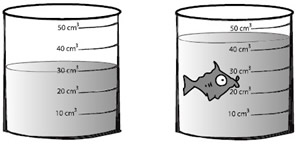
Para medir o volume do peixe pode-se colocar água num copo graduado e, em seguida, mergulhar o peixe lá dentro, como se vê na figura. A diferença de volume visto pela graduação do copo é o volume ocupado pelo peixe. Pode-se fazer isso com qualquer objeto que deseja-se conhecer o volume.
Inércia
Propriedade que a matéria tem em permanecer na situação em que se encontra, seja em movimento, seja em repouso. Quanto maior for a massa de um corpo, mais difícil alterar seu movimento, e maior a inércia. A massa mede a inércia de um corpo.

Impenetrabilidade
Dois corpos não podem ocupar, simultaneamente o mesmo lugar no espaço.

O ar é uma matéria que ocupa espaço e que não deixa a água entrar molhando o papel.
Compressibilidade
Propriedade da matéria que consiste em ter volume reduzido quando submetida a determinada pressão.
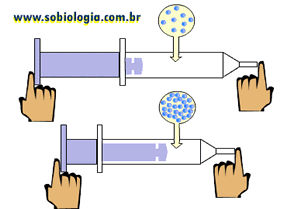
Ao puxar o êmbolo, o interior da seringa é preenchido pelo ar. Quando o êmbolo é empurrado, o ar em seu interior é comprimido, pois sua saida da seringa foi obstruida pelo dedo.
Elasticidade
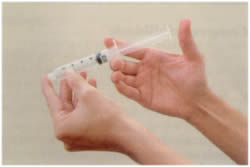 |
Propriedade que a matéria tem de retornar seu volume inicial - após cessada a força que causa a compressão.
O êmbolo está sendo empurrado para a saída de ar da seringa, mas essa saída é obstruida pelo dedo. O êmbolo, ao ser liberado da força a que era submetido, retorna à posição inicial na seringa, e isso mostra a elasticidade do ar.
|
Divisibilidade
Propriedade que a matéria tem se reduzir-se em partículas extremamente pequenas.

Indestrutibilidade
A matéria não pode ser criada nem destruída, apenas transformada. 
Propriedades Específicas da Matéria
Existem propriedades que são características de algumas matérias. Por exemplo, o ouro apresenta propriedades que o ferro não possui. Ele e o ferro apresentam propriedades que a água não tem. Já a água apresenta propriedades não encontradas no oxigênio, e assim por diante. Isso ocorre porque as substâncias ouro, ferro, água, oxigênio etc. são diferentes entre si.
As propriedades específicas nos permite distinguir uma substância de outra. Dentre as propriedades específicas, podemos citar:
- Propriedades físicas: ponto de fusão, ponto de ebulição, densidade.
- Propriedades organolépticas: São as propriedades percebidas pelos sentidos. São elas: odor, sabor, cor, brilho, etc.
- Propriedades químicas: reações químicas.
Cor
Diferentes materiais apresentam diferentes cores.
 Barra de ouro | 
Moedas de prata
|
Dureza
É definida pela resistência que a superfície oferece quando riscada por outro material. A substância mais dura que se conhece é o diamante, usado para cortar e riscar materiais como o vidro.

O quadro é mais duro que o giz, pois ele risca o giz que é desgastado.
Brilho
É a propriedade que faz com que os corpos reflitam a luz de modo diferente.
 |  |
Maleabilidade

Ductilidade
Propriedade que permite transformar materiais em fios. Um exemplo é o cobre, usado em forma de fios em instalações elétricas e o ferro na fabricação de arames.

Magnetismo
Algumas substâncias têm a propriedade de serem atraídas por ímãs, são as substâncias magnéticas.
Densidade
É também chamada de massa específica de uma substância, é a razão (d) entre a massa dessa substância e o volume por ela ocupado.
Com uma balança podemos determinar a massa de pedaços de cortiça de volume conhecido. Assim, por exemplo, determina-se experimentalmente que (para a variedade de cortiça utilizada):- 1 cm3 de cortiça tem massa 0,32 g;
- 2 cm3 de cortiça têm massa 0,64 g;
- 100 cm3 de cortiça têm massa 32 g;
- 1.000 cm3 de cortiça têm massa 320 g.
Analogamente, pode-se determinar a massa de pedaços de chumbo de volume conhecido. Chega-se, por exemplo, a que:
- 1 cm3 de chumbo tem massa 11,3 g;
- 2 cm3de chumbo têm massa 22,6 g;
- 100 cm3 de chumbo têm massa 1.130 g;
- 1.000 cm3 de chumbo têm massa 11.300 g.
Percebeu alguma regularidade?
A massa e o volume da cortiça são diretamente proporcionais. Quando o volume aumenta, a massa aumenta na mesma proporção. Matematicamente, podemos dizer que a razão (divisão) entre a massa e o volume de um pedaço de cortiça fornece resultado constante. O mesmo se pode afirmar para o chumbo.
O conceito da densidade
A razão entre a massa e o volume para a cortiça é:
O resultado obtido (0,32g/cm3) é a densidade da cortiça, grandeza que nos informa o quanto de massa existe em um certo volume. Um volume de 1cm3 de cortiça tem massa 0,32 g, um volume de 2 cm3 tem massa de 0,64g e assim por diante.
A densidade do chumbo (11,3 g/cm3) é, portanto, diferente da densidade da cortiça. Um centímetro cúbico de chumbo tem maior massa que um centímetro cúbico de cortiça.
Vamos definir de modo mais geral.Em palavras: A densidade de um objeto ou de uma amostra de certo material ou substância é o resultado da divisão da sua massa pelo seu volume.
Em equação:
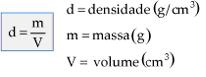
A unidade da densidade é composta por uma unidade de massa dividida por uma unidade de volume. Assim, podemos expressá-la, por exemplo, em g/cm3, g/L, kg/L etc.
Comparando densidades
O que tem a densidade a ver com a flutuação?
Para tentar responder a essa pergunta, vamos calcular a densidade da água. Antes disso, precisamos determinar experimentalmente o volume e a massa de uma ou mais amostras desse líquido.
Exemplos de resultados dessas determinações são:
- 1 cm3 de chumbo tem massa 1 g;
- 2 cm3 de chumbo têm massa 2 g;
- 100 cm3 de chumbo têm massa 100 g;
- 1.000 cm3 de chumbo têm massa 1.000 g.
Com esses dados chegamos a:
Assim, comparando os valores de densidades:
dágua = 1 g/cm3 , dcortiça = 0,32g/cm3 , dchumbo = 11,3 g/cm3
concluímos que: dcortiça < dágua< dchumbo
Densidade e flutuação
O resultado a que chegamos (dcortiça <>água <>chumbo) sugere que a cortiça flutua na água porque é menos densa que ela e que o chumbo afunda porque é mais denso que esse líquido. De fato, muitas evidências experimentais permitiram aos cientístas concluirem que essa afirmação é verdadeira.
A combinação entre as densidades permite prever se um corpo irá afundar ou flutuar em certo líquido. Imagine por exemplo, que uma bolinha de gude (d = 2,7 g /cm3) e um pedaço de isopor (d = 0,03 g/cm3) sejam colocados num frasco com azeite de oliva (d= 0,92g/cm3). O que podemos prever?
O pedaço de isopor, menos denso que o azeite, irá flutuar nele. E a bolina de gude, mais densa que ele, irá afundar.
Alguns fatores que afetam a densidade
A densidade depende, em primeiro lugar, do material considerado. Em segundo lugar; a densidade de um mesmo material depende da temperatura. Um aquecimento, por exemplo, provoca a dilatação do material (aumento de volume), e isso interfere no valor da densidade.
No caso dos gases, cujo volume é muito sensível a variação de pressão, a densidade, além de depender da temperatura, depende também da pressão.
Mudanças de estado físico provocam mudanças na densidade de uma substância. A água líquida, por exemplo, tem densidade de 1 g/cm3, e a água sólida (gelo) tem densidade 0,92 g/cm3. Isso permite entender porque o gelo flutua na água.
Estados Físicos da Matéria
Observando a natureza do nosso planeta, podemos perceber que a matéria se apresenta, à temperatura ambiente, em três estados físicos. As rochas da crosta terrestre estão no estado sólido. Nos mares, rios e lagos, a água se apresenta no estado líquido. E nossa atmosfera esta no estado gasoso.
A matéria é formada pela reunião de partículas que se atraem mutuamente. É a intensidade dessas forças de atração que determina em que estado de apresentará a matéria: sólido, líquido ou gasoso.
Estado Sólido
As substâncias apresentam formas definidas e seu volume não varia de forma considerável com variações de temperatura e pressão.

As partículas que constituem o sólido encontram-se ligadas uma às outras por uma força de tração muito grande de modo que não podem movimentar-se livremente, vibrando apenas em posições fixas.

As partículas que constituem o sólido encontram-se ligadas uma às outras por uma força de tração muito grande de modo que não podem movimentar-se livremente, vibrando apenas em posições fixas.
Estado Líquido
As partículas que constituem o estado líquido não estão unidas fortemente, visto que deslizam uma sobre as outras, adaptando-se à forma do recipiente que as contém, mas estas forças de atração entre as partículas são suficientemente fortes para que não ocorra variação no volume e as partículas dificilmente podem ser comprimidas.

Estado Gasoso
As substâncias apresentam densidade menor que a dos sólidos e líquidos, ocupam todo o volume do recipiente que as contém, podem expandir-se indefinidamente e são comprimidas com grande facilidade. Este comportamento pode ser explicado pelas forças de atração entre as partículas muito fracas as quais possuem, portanto, alta mobilidade.
Mudanças de Estado
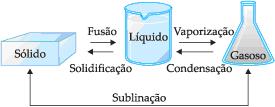 |
|
Ponto de Fusão: é a temperatura constante na qual um sólido se transforma num líquido. Os pontos de fusão e solidificação ocorrem numa mesma temperatura.
Ponto de Ebulição: é a temperatura constante na qual um líquido passa para o estado gasoso.
Substâncias químicas
Como você vê, o conceito de substância química – ou simplesmente substância, como iremos chamar de agora em diante – está intimamente relacionada ao estudo da química.
Os químicos consideram que uma substância é uma porção de matéria que tem propriedades bem definidas e que lhe são características. Da mesma maneira como você consegue reconhecer um amigo por um conjunto de suas características (a cor da pele, o timbre de voz, a forma do nariz, o modo de andar, o jeito de falar, a cor e a textura dos cabelos, o porte físico etc.), os químicos identificam as substâncias pelo conjunto de suas propriedades.
 |
Entre essas propriedades estão o ponto de fusão, o ponto de ebulição, a densidade, o fato de ser inflamável ou não, a cor, o odor etc.
Duas substâncias diferentes podem, eventualmente, possuir uma ou duas propriedades iguais, mas nunca todas elas. Caso aconteça de todas as propriedades de duas substâncias serem iguais, então elas são, na verdade, a mesma substância.
Uma amostra de água, qualquer que seja a sua origem (chuva, rio, mar, lago, geleira, produzida em laboratório etc.), tem sempre as mesmas propriedades.
Assim, qualquer líquido incolor com PF = 0ºC, PE = 100ºC e d = 1,0 g/cm3 é classificado como água. E assim por diante.
|
Quando uma substância é produzida em laboratório ou extraída de alguma fonte natural, e desconfiam-se que seja uma nova substância, os químicos primeiramente determinam as suas propriedades.
Se elas coincidirem totalmente com as de alguma substância já conhecida, então não se tratará de uma nova substância. Se, por outro lado, não houver substância conhecida com essas propriedades, então realmente terá sido descoberta uma nova substância.
Substâncias simples e substâncias compostas
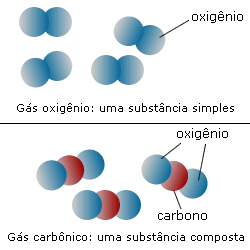 |
A molécula de água é formada por dois átomos de hidrogênio e um de oxigênio. Já o gás nitrogênio, que existe na atmosfera, é formado pela união de dois átomos de nitrogênio. O mesmo vale para o gás oxigênio. Dizemos então que o oxigênio é uma substância simples, já que é formado pela união de átomos quimicamente iguais. A água é uma substância composta, pois é formada pela união de átomos diferentes.
Compreenda melhor analisando a imagem a seguir:
Algumas substâncias compostas são formadas por íons diferentes, como é o caso do cloreto de sódio, que tem íons de sódio e de cloro.
Portanto, uma substância pura pode ser simples, quando é formada por apenas um tipo de átomo, ou composta, quando em sua fórmula há mais de um tipo de átomo ou de íon. |
Resumindo:
Substâncias Simples são aquelas formadas por um único tipo de elemento químico.
Exemplos: H2, O2, O3, Cl2, P4 .
Substâncias compostas são aquelas formadas por mais de um tipo de elemento químico.
Exemplos: NaCl, H2O, Ca2SO4, HCl, H3PO4.
Solução e solubilidade
As misturas homogêneas são também chamadas soluções. Os componentes (substâncias presentes) de uma solução podem estar nos estados: sólido, líquido ou gasoso. Podemos dizer que a solução é um tipo de matéria formada por um solvente e um soluto.
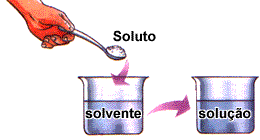 |
Soluto é a substância que se encontra dissolvida no solvente. Solvente é a substância que dissolve o soluto. Por exemplo, a salmoura é um tipo de matéria composta por uma solução formada por sal e água. O sal é o soluto, pois está dissolvido na água, e a água é o solvente, já que dissolve o sal.
Existem também as misturas de gases, chamadas misturas gasosas. Independentemente da proporção de cada um de seus componentes, a mistura gasosa á uma solução, ou seja, uma mistura homogênea. Isso explica, por exemplo, por que não podemos ver o vapor de água misturados aos demais gases da atmosfera.
|
Outras misturas homogêneas ou soluções são o ar atmosférico, a gasolina etc.
De acordo com a quantidade de soluto em relação à de solvente, a solução pode ser:
- diluída – pequena quantidade de soluto
- concentrada – grande quantidade de soluto
- saturada – soluto em quantidade máxima que o solvente pode dissolver.
O coeficiente de solubilidade de uma substância indica a quantidade máxima de um soluto que pode ser dissolvido em um determinado solvente. Esse valor varia com a temperatura.
Há várias maneiras de indicar a quantidade de soluto presente numa solução. Uma das mais utilizadas é a concentração comum, calculada utilizando-se a equação:
em que: C é a concentração;
m é a massa do soluto expressa em gramas;
V é o volume da solução expresso em litro.
A concentração de sal na água do mar é, em média, de 30 g/L, isto é, em cada litro de água do mar há 30 gramas de sal. Nas regiões salineiras a concentração é superior a essa média.
Separação dos componentes de uma mistura
Como os materiais encontrados na natureza, na sua maioria, são constituídos de misturas de substâncias puras, para obtê-las, a partir das substâncias compostas é necessário separá-las por um método adequado.
Existem muitos processos para separação de misturas, mas o método a ser empregado depende das condições materiais para utilizá-lo e do tipo de mistura a ser separado.
Você já pensou em como separar algumas misturas que são encontradas no seu cotidiano?
Para isso é necessário, em primeiro lugar, observar se a mistura em questão é homogênea ou heterogênea, para em seguida escolher o processo mais adequado para separá-la.
Os processos mais utilizados para separação de misturas
1) Catação, Ventilação, Levigação, Peneiração, Separação Magnética e Flotação, usados na separação de misturas heterogêneas constituídas de dois componentes sólidos.
Catação: É um processo simples de separar sólidos numa mistura heterogênea. Os grãos ou fragmentos de um dos componentes são catados com as mãos ou com uma pinça. 
Ventilação: A ventilação é usada para separa sólidos menos densos, passando-se pela mistura uma corrente de ar que arrasta o mais leve.
Levigação: passa-se pela mistura uma corrente de água e esta arrasta o mais leve.

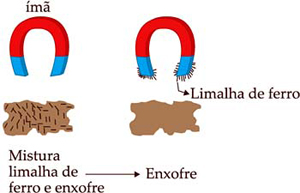
Separação magnética: passa-se pela mistura um imã, se um dos componentes possuírem propriedades magnéticas, será atraído pelo imã.
Peneiração: usada quando os grãos que formam os componentes tem tamanhos diferentes.

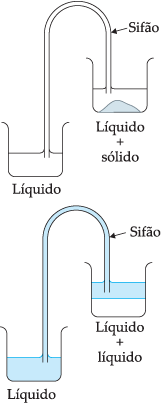
Sifonação: É um processo usado para separar as fases da mistura heterogênea sólido/líquido e líquido/líquido.
Flotação: é um processo de separação onde estão envolvidos os três estados da matéria - sólido, líquido e gasoso. As partículas sólidas desejadas acumulam-se nas bolhas gasosas introduzidas no líquido. As bolhas têm densidade menor que a da fase líquida e migram para superfície arrastando as partículas seletivamente aderidas. O produto não desejável é retirado pela parte inferior do recipiente.

Decantação: usado para separar os componentes de misturas heterogêneas, constituídas de um componente sólido e outro líquido ou de dois componentes líquidos, estes líquidos devem ser imiscíveis. Esse método consiste em deixar a mistura em repouso e o componente mais denso, sob a ação da força da gravidade, formará a fase inferior e o menos denso ocupará a fase superior.
 |  |
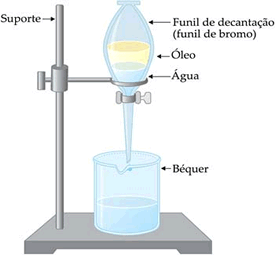
Quando a mistura a ser separada é constituída de dois líquidos imiscíveis, pode se utilizar um funil de vidro, conhecido como Funil de Decantação ou Funil de Bromo. A decantação é usada nas estações de tratamento de água, para precipitar os componentes sólidos que estão misturados com a água.
Centrifugação: é usado para acelerar a decantação da fase mais densa de uma mistura heterogênea constituída de um componente sólido e outro líquido. Esse método consiste em submeter a mistura a um movimento de rotação intenso de tal forma que o componente mais denso se deposite no fundo do recipiente.
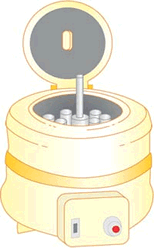
A manteiga é separada do leite por centrifugação. Como o leite é mais denso que a manteiga, formará a fase inferior.
Nos laboratórios de análise clínica o sangue, que é uma mistura heterogênea, é submetido a centrifugação para separação dos seus componentes.
A centrifugação é utilizada na máquina de lavar roupa, na separação da água e do tecido que constitui a roupa.
Filtração: é usada para separação de misturas heterogêneas, constituídas de um componente sólido e outro líquido ou de um componente sólido e outro gasoso. A mistura deve passar através de um filtro, que é constituído de um material poroso, e as partículas de maior diâmetro ficam retidas no filtro. Para um material poder ser utilizado como filtro seus poros devem ter um diâmetro muitíssimo pequeno.
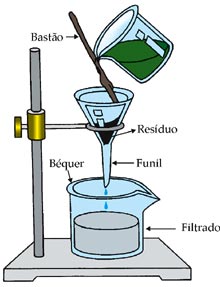
A filtração é o processo de separação utilizado no aspirador de pó. O ar e a poeira são aspirados, passam pelo filtro, que é chamado saco de poeira, as partículas sólidas da poeira ficam retidas no filtro e o ar sai.
Evaporação: é usado para separação de misturas homogêneas constituída de um componente sólido e o outro líquido. A evaporação é usada para separar misturas, quando apenas a fase sólida é de interesse.
O sal de cozinha é extraído da água do mar por evaporação. A água do mar é represada em grandes tanques, de pequena profundidade, construídos na areia, chamados de salinas. Sob a ação do sol e dos ventos a água do mar represada nas salinas sofre evaporação e o sal de cozinha e outros componentes sólidos vão se depositando no fundo dos tanques.
O sal de cozinha é extraído da água do mar por evaporação. A água do mar é represada em grandes tanques, de pequena profundidade, construídos na areia, chamados de salinas. Sob a ação do sol e dos ventos a água do mar represada nas salinas sofre evaporação e o sal de cozinha e outros componentes sólidos vão se depositando no fundo dos tanques.
O sal grosso obtido nas salinas, além do uso doméstico, também é utilizado em países de inverno muito rigoroso, para derreter a neve, visto que o gelo cobre as ruas, estradas, pastagens. Isso ocorre porque ao dissolvermos uma substância em um líquido esta diminui o ponto de congelação do líquido.
|  |
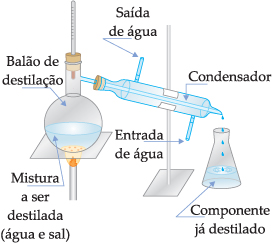
Destilação simples: é usada para separar misturas homogêneas quando um dos componentes é sólido e o outro líquido. A destilação simples é utilizada quando há interesse nas duas fases. Este processo consiste em aquecer a mistura em uma aparelhagem apropriada, como a esquematizada abaixo, até que o líquido entre em ebulição. Como o vapor do líquido é menos denso, sairá pela parte superior do balão de destilação chegando ao condensador, que é refrigerado com água, entra em contato com as paredes frias, se condensa, voltando novamente ao estado líquido. Em seguida, é recolhido em um recipiente adequado, e o sólido permanece no balão de destilação.
Destilação Fracionada: é usada na separação de misturas homogêneas quando os componentes da mistura são líquidos. A destilação fracionada é baseada nos diferentes pontos de ebulição dos componentes da mistura. A técnica e a aparelhagem utilizada na destilação fracionada é a mesma utilizada na destilação simples, apenas deve ser colocado um termômetro no balão de destilação, para que se possa saber o término da destilação do líquido de menor ponto de ebulição. O término da destilação do líquido de menor ponto de ebulição, ocorrerá quando a temperatura voltar a se elevar rapidamente.
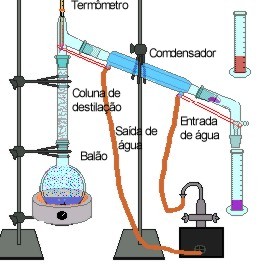
A destilação fracionada é utilizada na separação dos componentes do petróleo. O petróleo é uma substância oleosa, menos densa que a água, formado por uma mistura de substâncias. O petróleo bruto é extraído do subsolo da crosta terrestre e pode estar misturado com água salgada, areia e argila. Por decantação separa-se a água salgada, por filtração a areia e a argila. Após este tratamento, o petróleo, é submetido a um fracionamento para separação de seus componentes, por destilação fracionada. As principais frações obtidas na destilação do petróleo são: fração gasosa, na qual se encontra o gás de cozinha; fração da gasolina e da benzina; fração do óleo diesel e óleos lubrificantes, e resíduos como a vaselina, asfalto e pixe.
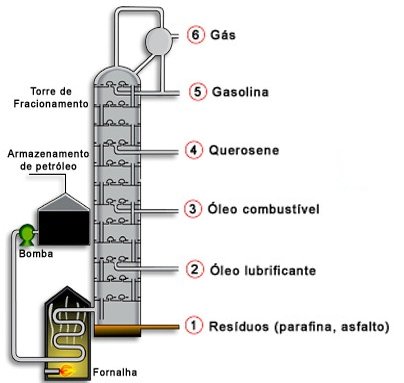
A destilação fracionada também é utilizada na separação dos componentes de uma mistura gasosa. Primeiro, a mistura gasosa deve ser liqüefeita através da diminuição da temperatura e aumento da pressão. Após a liquefação, submete-se a mistura a uma destilação fracionada: o gás de menor ponto de ebulição volta para o estado gasoso. Esse processo é utilizado para separação do oxigênio do ar atmosférico, que é constituído de aproximadamente 79% de nitrogênio e 20% de oxigênio e 1% de outros gases. No caso desta mistura o gás de menor ponto de ebulição é o nitrogênio.
Quadro resumo dos métodos de separação de misturas
Misturas Homogêneas
MÉTODO
|
PROCESSO
|
Destilação Simples (Sólido + Líquido)
|
Por aquecimento, só o líquido entra em ebulição, vaporiza-se e a seguir condensa-se, separando-se do sólido
|
Destilação Fracionada (Líquido + Líquido)
|
Por aquecimento, os líquidos vaporizam-se e a seguir condensam-se, à medida que vão sendo atingidos seus pontos de ebulição
|
Líquefação Fracionada (Gás + Gás)
|
Por resfriamento da mistura, os gases se liqüefazem separadamente, à medida que vão sendo atingidos os seus pontos de ebulição.
|
Aquecimento Simples (Gás + Líquido)
|
Por aquecimento abaixo do ponto de ebulição do líquido, ó gás dissolvido é expulso.
|
Misturas Heterogêneas
MÉTODO
|
PROCESSO
|
Catação (Sólido + Sólido)
|
Os fragmentos são catados com a mão ou pinça
|
Ventilação (Sólido + Sólido)
|
Separação do componente mais leva por corrente de ar.
|
Levigação (Sólido + Sólido)
|
Separação do componente mais leva por corrente de água.
|
Dissolução Fracionada (Sólido + Sólido)
|
Separação por meio de um líquido que dissolve apenas um componente.
|
Separação Magnética (Sólido + Sólido)
|
Apenas um componente é atraído pelo ímã.
|
Fusão Fracionada (Sólido + Sólido)
|
Separação por aquecimento da mistura até a fusão do componente de menor ponto de fusão.
|
Cristalização Fracionada (Sólido + Líquido)
|
Adiciona-se um líquido que dissolva todos os sólidos. Por evaporação da solução obtida, os componentes cristalizam-se separaddamente.
|
Peneiração ou Tamização (Sólido + Sólido)
|
Os componentes estão reduzidos a grãos de diferentes tamanhos.
|
Sedimentação
|
Separação de duas ou mais camadas devido a diferentes densidades.
|
Decantação (Sólido + Líquido)
|
Após a sedimentação a fase líquida é escoada.
|
Filtração (Sólido + Líquido)
|
Separa a fase líquida ou gasosa da sólida por meio de uma superfície porosa.
|
Centrifugação (Sólido + Líquido)
|
Decantação acelerada por uma centrífuga.
|
Ligas metálicas
Para produção de objetos, ornamentos, utensílios domésticos muitas vezes é necessário separar os componentes de um mistura para obtenção das substâncias puras, mas outras vezes é necessário fazermos misturas de substâncias para obtermos alguns materiais. Quando nessas misturas um dos componentes é um metal forma-se um liga metálica.
As ligas metálicas apresentam características diferentes dos metais puros e por isso podem ser utilizadas com maior vantagem em relação ao metal puro. As ligas de cobre e cromo são usadas em resistências elétricas como a de chuveiro porque ocorre a diminuição da condutividade elétrica, em outras ligas ocorre o aumento da resistência mecânica, a resistência a corrosão, a ductibilidade etc.
Liga metálica
|
Componentes
|
Característica
|
Uso
|
Latão
|
Cobre e Zinco
|
resistente à corrosão
|
navios, tubos
|
Bronze
|
Cobre e Estanho
|
resistente à corrosão
|
moedas, sinos
|
Aço
|
Ferro e carbono
|
resistente à corrosão
|
navios, utensílios domésticos
|
Aço inoxidável
|
Aço e Cromo
|
resistente à corrosão
|
talheres, utensílios domésticos
|
Aço -Níquel
|
Aço e Níquel
|
resistência mecânica
|
canhões, material de blindagem
|
Aço-Tungstênio
|
Aço e Tungstênio
|
alta dureza
|
brocas, pontas de caneta
|
Alnico
|
Aço, alumínio, níquel e cobalto
|
propriedades magnéticas
|
fabricação de imãs
|
Amálgama
|
Mercúrio, prata e estanho
|
restauração de dentes
| |
Ouro 18 quilates
|
Ouro e cobre
|
alta ductibilidade e maleabilidade
|
jóias
|
Prata de lei
|
Prata e cobre
|
aumento da dureza
|
utensílios domésticos,
ornamentos |
Electron Liga de magnésio
|
Mg, alumínio, manganês, zinco
|
resistência mecânica e térmica
|
peças muito leves
|
Nenhum comentário:
Postar um comentário